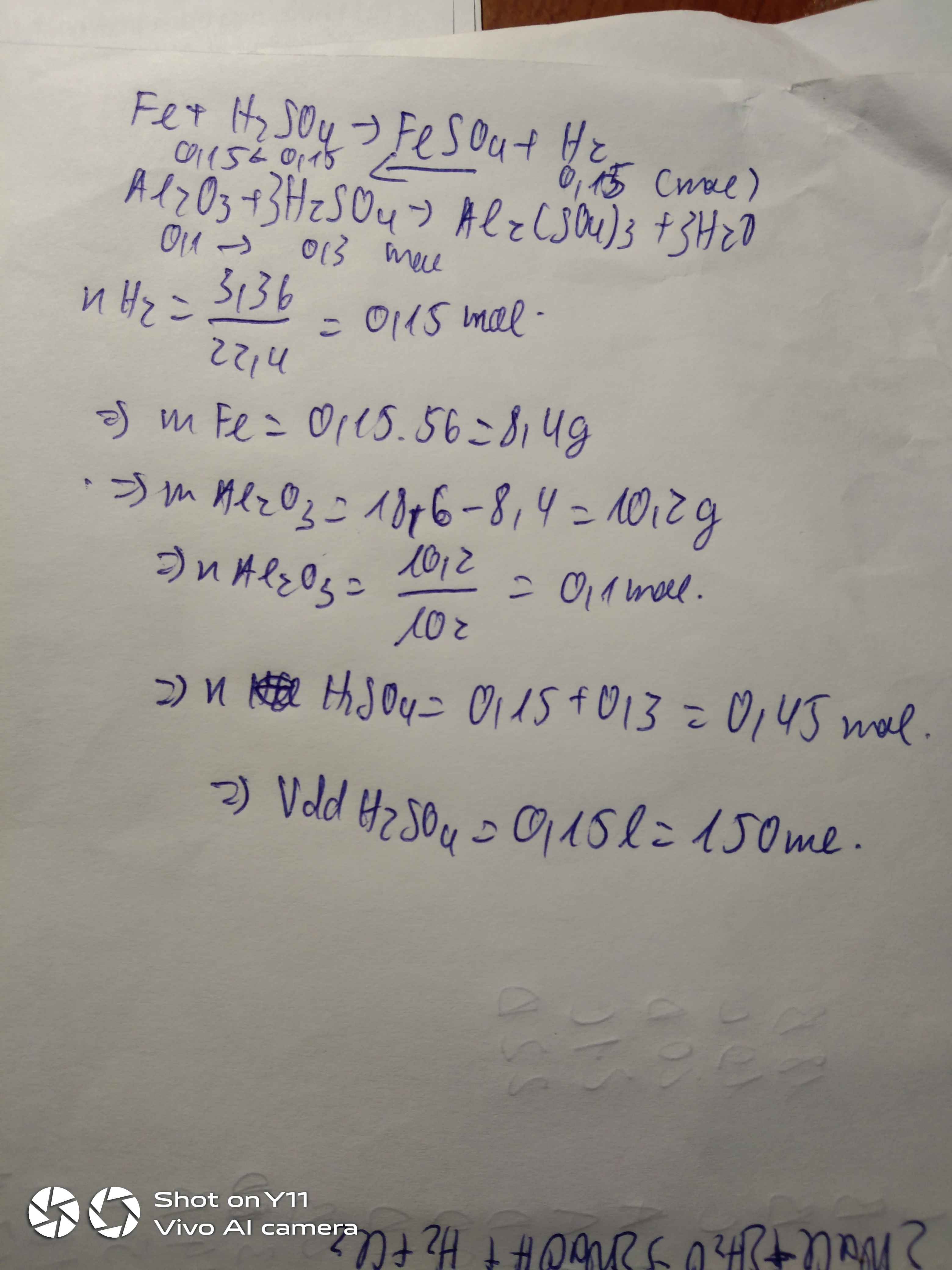Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nH2=0,84(mol)
PTHH: Fe + 2 HCl -> FeCl2 + H2
0,84__________________0,84(mol)
=>mFe=0,84.56=47,04(g)
=> mCaCO3=48,8-47,04=1,76(g)
b) %mCaCO3=(1,76/48,8).100=3,607%
=>%mFe= 96,393%
PTHH: \(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
\(CaCO_3+2HCl\rightarrow CaCl_2+H_2O+CO_2\uparrow\)
Ta có: \(n_{Fe}=n_{H_2}=\dfrac{18,816}{22,4}=0,84\left(mol\right)\)
\(\Rightarrow m_{Fe}=0,84\cdot56=47,04\left(g\right)\) \(\Rightarrow m_{CaCO_3}=1,76\left(g\right)\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{CaCO_3}=\dfrac{1,76}{48,8}\cdot100\%\approx3,61\%\\\%m_{Fe}=96,39\%\end{matrix}\right.\)

Bài 1: gọi a,b là ố mol của Mg và Al
Mg + 2HCl - > MgCl2 + H2
-a---------------------------------a
Al + 3HCl -> AlCl3 + 3/2H2
-b---------------------b-------3/2b-
Ta có 24a+27b=7.8 g (1)
Mà bạn thấy nhé! Hòa tan 7,8g kim loại HOÀN TOÀN vào HCl dư mà dung dịch chỉ tăng thêm 7g
=> 0,8g mất đi là do H2 bay hơi -> nH2 = 0.4 mol
Có thêm a+3/2b=0.4 (2)
từ 1 và 2 ta có hệ pt: \(\begin{cases}24a+27b=7,8\\a+\frac{3}{2}b=0,4\end{cases}\)
<=> \(\begin{cases}a=0,1\\b=0,2\end{cases}\)
=> mMg =0,1.24=2,4g
=> mAl=7,8-2,4=5,4g
Bài 2: H2+Cl2=>2HCl
Theo định luật bảo toàn thì là 5 lít thôi
H=20%=> V=5:100.20=1lit

Bài 2
mol HCl=3.0,1=0,3mol(100ml=0,1l)
CuO+2HCl->CuCl2+H2O (1)
xmol 2xmol
ZnO+2HCl->ZnCl2+H2O(2)
ymol 2ymol
Từ 1 và 2 ta co hệ phương trình
2x+2y=0,3 ->x=0,05=molCuO
80x+81y=12,1 ->y=0,1=molZnO
=>mCuO=0,05.80=4g
->%CuO=(4.100)/12,1=33,075%
->%ZnO=100-33,075=66,943%
b. CuO+H2SO4->CuSO4+H2O (3)
Theo ptpu 3 taco nH2SO4=nCuO=0,05 mol
ZnO+H2SO4->ZnSO4+H2O (4)
Theo ptpu 4 ta co nH2SO4=nZnO=0,1mol
=>nH2SO4=0.05+0,1=0,15mol
->mH2SO4=0,15.98=14,7g
=>mddH2SO4=(14,7.100)/20=73,5g
Bài 1
a/. Phương trình phản ứng hoá học:
Fe + 2HCl --> FeCl2 + H2
b/. nH2 = V/22,4 = 3,36/22,4 = 0,15 (mol)
....... Fe.....+ 2HCl --> Fecl2 + H2
TPT 1 mol....2 mol.................1 mol
TDB x mol....y mol................0,15 mol
nFe = x = (0,15x1)/1 = 0,15 (mol)
mFe = n x M = 0,15 x 56 = 8,4 (g)
c/. nHCl = y = (0,15x2)/1 = 0,3 (mol)
CMHCl = n/V = 0,3/0,05 = 6 (M)

1.GS có 100g dd $HCl$
=>m$HCl$=100.20%=20g
=>n$HCl$=20/36,5=40/73 mol
=>n$H2$=20/73 mol
Gọi n$Fe$(X)=a mol n$Mg$(X)=b mol
=>n$HCl$=2a+2b=40/73
mdd sau pứ=56a+24b+100-40/73=56a+24b+99,452gam
m$MgCl2$=95b gam
C% dd $MgCl2$=11,79%=>95b=11,79%(56a+24b+99,452)
=>92,17b-6,6024a=11,725
=>a=0,13695 mol và b=0,137 mol
=>C%dd $FeCl2$=127.0,13695/mdd.100%=15,753%
2.Bảo toàn klg=>mhh khí bđ=m$C2H2$+m$H2$
=0,045.26+0,1.2=1,37 gam
mC=mA-mbình tăng=1,37-0,41=0,96 gam
HH khí C gồm $H2$ dư và $C2H6$ không bị hấp thụ bởi dd $Br2$ gọi số mol lần lượt là a và b mol
Mhh khí=8.2=16 g/mol
mhh khí=0,96=2a+30b
nhh khí=0,06=a+b
=>a=b=0,03 mol
Vậy n$H2$=n$C2H6$=0,03 mol

Zn + 2HCl → ZnCl2 + H2 (1)
ZnO + 2HCl → ZnCl2 + H2 (2)
\(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
Gọi \(x\) là số mol Zn
\(\Rightarrow n_{ZnO}=2x\left(mol\right)\)
Theo Pt1: \(n_{H_2}=n_{Zn}=x\left(mol\right)\)
Theo PT2: \(n_{H_2}=n_{ZnO}=2x\left(mol\right)\)
\(\Rightarrow\Sigma n_{H_2}=x+2x=0,15\)
\(\Leftrightarrow3x=0,15\)
\(\Leftrightarrow x=0,05\left(mol\right)\)
Vậy \(n_{Zn}=0,05\left(mol\right)\Rightarrow m_{Zn}=0,05\times65=3,25\left(g\right)\)
\(n_{ZnO}=2\times0,05=0,1\left(mol\right)\Rightarrow m_{ZnO}=0,1\times81=8,1\left(g\right)\)

Mg + 2HCl ----> MgCl2 + H2
0,2 0,4 0,2 (mol)
MgO + 2HCl ----> MgCl2 + H2O
0,2 0,4 (mol)
=> mMg = 0,2.24 = 4,8 (g)
=> %Mg = \(\dfrac{4,8.100}{12,8}\)= 37,5%
=> mMgO = 12,8 - 4,8 = 8 (g)
=> %MgO = \(\dfrac{8.100}{12,8}\)= 62,5%
nMgO = 8/40 = 0,2 (mol)
=> nHCl = 0,4 + 0,4 = 0,8 (mol)
=> VHCl = 0,8/2 = 0,4 (l)