Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
Vì khối lượng hai phần bằng nhau nên thể tích khí H2 thu được ở hai trường hợp bằng nhau.
Khối lượng mỗi phần là 11,6 gam.
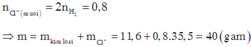

Đáp án B
► Xét phần 1: Y + NaOH → H2.
Mặt khác, phản ứng xảy ra hoàn toàn ⇒ Al dư.
nAl dư = 0,15 ÷ 1,5 = 0,1 mol. Phần không tan T là Fe
⇒ nFe = nH2 = 0,45 mol.
Lần lượt bảo toàn nguyên tố Oxi và Fe
⇒ nAl2O3 = 0,2 mol.
● GIẢ SỬ phần 1 tác dụng với HCl thì nH2 = 0,1 × 1,5 + 0,45 = 0,6 mol.
||⇒ phần 2 gấp 1,2 ÷ 0,6 = 2 lần phần 1
⇒ lượng ban đầu gấp 3 lần phần 1.
► m = 3 × (0,1 × 27 + 0,2 × 102 + 0,45 × 56) = 144,9(g)

Đáp án B
Phương pháp: Do P1+NaOH sinh ra H2 nên trong phản ứng nhiệt nhôm l dư.
Chú ý: Chia thành 2 phần không bằng nhau.
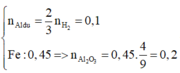
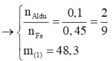
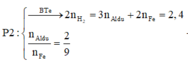

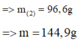

Đáp án B
· Phần 1: + NaOH ® 0,045 mol H2
Þ Chứng tỏ oxit sắt phản ứng hết, Al dư:
![]()
Chất rắn còn lại là Fe:
![]()
· Phần 1: Có
Þ Chứng tỏ phần 2 nhiều gấp 3 lần phần 1.
· Khối lượng kết tủa lớn nhất khi toàn bộ lượng Al3+ và Fe3+ tạo kết tủa
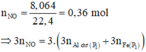
Þ Chứng tỏ phần 2 nhiều gấp 3 lần phần 1.
· Khối lượng kết tủa lớn nhất khi toàn bộ lượng Al3+ và Fe3+ tạo kết tủa.
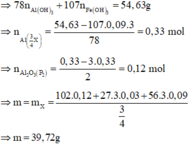

Đáp án D
* Phần 1: nFe = nH2 = 0,1; nCu = a
* Phần 2: nNO2 = 1,25; nFe = 0,1k và nCu = ak
Ta có hệ
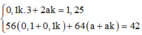
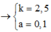
=> m = 0,25.242 + 0,25.188 = 107,5 gam
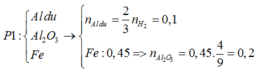
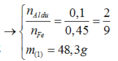
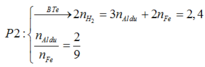
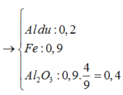
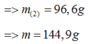

Gọi: \(\left\{{}\begin{matrix}n_{Al}=x\left(mol\right)\\n_{Cr}=y\left(mol\right)\end{matrix}\right.\) (trong 1 phần)
_ Phần 1: nH2 = 0,2 (mol)
BT e, có: 3x + 2y = 0,2.2 (1)
_ Phần 2: nH2 = 0,15 (mol)
BT e, có: 3x = 0,15.2 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,1\left(mol\right)\\y=0,05\left(mol\right)\end{matrix}\right.\)
⇒ m = 2.(0,1.27 + 0,05.52) = 10,6 (g)
→ Đáp án: A
Bạn tham khảo nhé!
Vâng cám ơn cậu nhiều nhé 🥰