Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a. Để tính khối lượng HCl đã dùng, ta cần biết số mol của Al đã phản ứng với HCl. Ta sử dụng phương trình phản ứng:
2Al + 6HCl → 2AlCl3 + 3H2
Theo đó, 2 mol Al tương ứng với 6 mol HCl. Vậy số mol HCl cần để phản ứng với 2,7 g Al là:
n(HCl) = n(Al) x (6/2) = 2,7/(27x2) x 6 = 0,05 mol
Khối lượng HCl tương ứng là:
m(HCl) = n(HCl) x M(HCl) = 0,05 x 36,5 = 1,825 g
Vậy khối lượng HCl đã dùng là 1,825 g.
b. Theo phương trình phản ứng, 2 mol Al tạo ra 3 mol H2. Vậy số mol H2 tạo ra từ 2,7 g Al là:
n(H2) = n(Al) x (3/2) = 2,7/(27x2) x 3 = 0,025 mol
Theo định luật Avogadro, 1 mol khí ở ĐKTC chiếm thể tích 22,4 L. Vậy thể tích H2 thu được là:
V(H2) = n(H2) x 22,4 = 0,025 x 22,4 = 0,56 L
P.c. CuO + H2 → Cu + H2O
Khối lượng CuO cần để khử hết 0,025 mol H2 là:
n(CuO) = n(H2)/2 = 0,0125 mol
m(CuO) = n(CuO) x M(CuO) = 0,0125 x 79,5 = 0,994 g
Vậy để khử hết H2, ta cần dùng 0,994 g CuO. Nếu dùng toàn bộ lượng H2 bay ra, chất CuO sẽ bị khử hoàn toàn thành Cu và không còn chất nào còn dư.

a, PT: \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
b, Ta có: \(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\)
Theo PT: \(n_{H_2}=n_{Zn}=0,1\left(mol\right)\Rightarrow V_{H_2}=0,1.22,4=2,24\left(l\right)\)
c, PT: \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
Theo PT: \(n_{Fe}=\dfrac{2}{3}n_{H_2}=\dfrac{1}{15}\left(mol\right)\Rightarrow m_{Fe}=\dfrac{1}{15}.56=\dfrac{56}{15}\left(g\right)\)

a. \(Fe+2HCl\rightarrow FeCl_2+H_2\)
b. \(n_{Fe}=\dfrac{m_{Fe}}{M_{Fe}}=\dfrac{28}{56}=0,5\left(mol\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
0,5-------1---------0,5-----0,5
Theo PTHH: \(\Rightarrow n_{H_2}=n_{Fe}=0,5\left(mol\right)\)
\(V_{H_2}=n_{H_2}.22,4=0,5.22,4=11,2\left(l\right)\)
c. \(H_2+CuO\rightarrow Cu+H_2O\)
0,5-------0,5-----0,5----0,5
\(\Rightarrow m_{Cu}=n_{Cu}.M_{Cu}=0,5.64=32\left(g\right)\)

\(n_{Zn}=\dfrac{19,5}{65}=0,3\left(mol\right)\\
pthh:Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,3 0,3
\(V_{H_2}=0,3.22,4=6,72l\\ n_{Fe_2O_3}=\dfrac{19,2}{160}=0,12g\\ pthh:Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\\ LTL:\dfrac{0,12}{1}>\dfrac{0,3}{3}\)
=> Fe2O3 dư
\(n_{Fe}=\dfrac{2}{3}n_{H_2}=0,2\left(mol\right)\\
m_{Fe}=0,2.56=11,2g\)
a.\(n_{Zn}=\dfrac{19,5}{65}=0,3mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,3 0,3 ( mol )
\(V_{H_2}=0,3.22,4=6,72l\)
b.\(n_{Fe_2O_3}=\dfrac{19,2}{160}=0,12mol\)
\(Fe_2O_3+3H_2\rightarrow\left(t^o\right)2Fe+3H_2O\)
0,12 > 0,3 ( mol )
0,3 0,2 ( mol )
\(m_{Fe}=0,2.56=11,2g\)

\(19,6\rightarrow19,5\\ n_{Zn}=\dfrac{19,5}{65}=0,3\left(mol\right)\)
PTHH: Zn + 2HCl ---> ZnCl2 + H2
0,3----------------------->0,3
=> VH2 = 0,3.22,4 = 6,72 (l)
\(n_{Fe_2O_3}=\dfrac{19,2}{160}=0,12\left(mol\right)\)
PTHH: Fe2O3 + 3H2 --to--> 2Fe + 3H2O
LTL: \(0,12>\dfrac{0,3}{3}\) => Fe2O3 dư
\(n_{Fe}=\dfrac{2}{3}.0,3=0,2\left(mol\right)\\ \rightarrow m_{Fe}=0,2.56=11,2\left(g\right)\)
\(n_{Zn}=\dfrac{19,6}{65}=0,3\left(mol\right)\\
pthh:Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,3 0,6 0,3 0,3
\(V_{H_2}=0,3.22,4=6,72L\)
\(n_{Fe_2O_3}=\dfrac{19,2}{160}=0,12\left(mol\right)\\
pthh:Fe_2O_3+3H_2\rightarrow2Fe+3H_2O\)
\(ltl:\dfrac{0,12}{1}>\dfrac{0,3}{3}\)
= > Fe2O3 dư
\(n_{Fe}=n_{H_2}=0,3\left(mol\right)\\
m_{Fe}=0,3.56=16,8g\)

a) \(n_{Fe}=\dfrac{m_{Fe}}{M_{Fe}}=\dfrac{28}{56}=0,5\left(mol\right)\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
0,5-------1---------0,5------0,5
b) \(V_{H_2}=n_{H_2}.22,4=0,5.22,4=11,2\left(l\right)\)
c) \(H_2+CuO\rightarrow Cu+H_2O\)
0,5-----0,5------0,5----0,5
Khối lượng đồng tạo thành: \(m_{Cu}=n_{Cu}.64=0,5.64=32\left(g\right)\)

a) \(n_{Fe}=\dfrac{28}{56}=0,5\left(mol\right)\)
PTHH: `Fe + 2HCl -> FeCl_2 + H_2`
0,5-------------------------->0,5`
b) `V_{H_2} = 0,5.22,4 = 11,2 (l)`
c) PTHH: \(CuO+H_2\xrightarrow[]{t^o}Cu+H_2O\)
0,5---->0,5
`=> m_{Cu} = 0,5.64 = 32 (g)`
\(Fe+2HCl\underrightarrow{t^o}FeCl_2+H_2\)
\(1mol\) \(1mol\)
\(0,5mol\) \(0,5mol\)
\(n_{Fe}=\dfrac{m}{M}=\dfrac{28}{56}=0,5\left(mol\right)\)
\(V_{H_2}=n.22,4=0,5.22,4=11,2\left(l\right)\)
\(H_2+CuO\underrightarrow{t^o}Cu+H_2O\)
\(1mol\) \(1mol\)
\(0,5mol\) \(0,5mol\)
\(m_{Cu}=n.M=0,5.64=32\left(g\right)\)
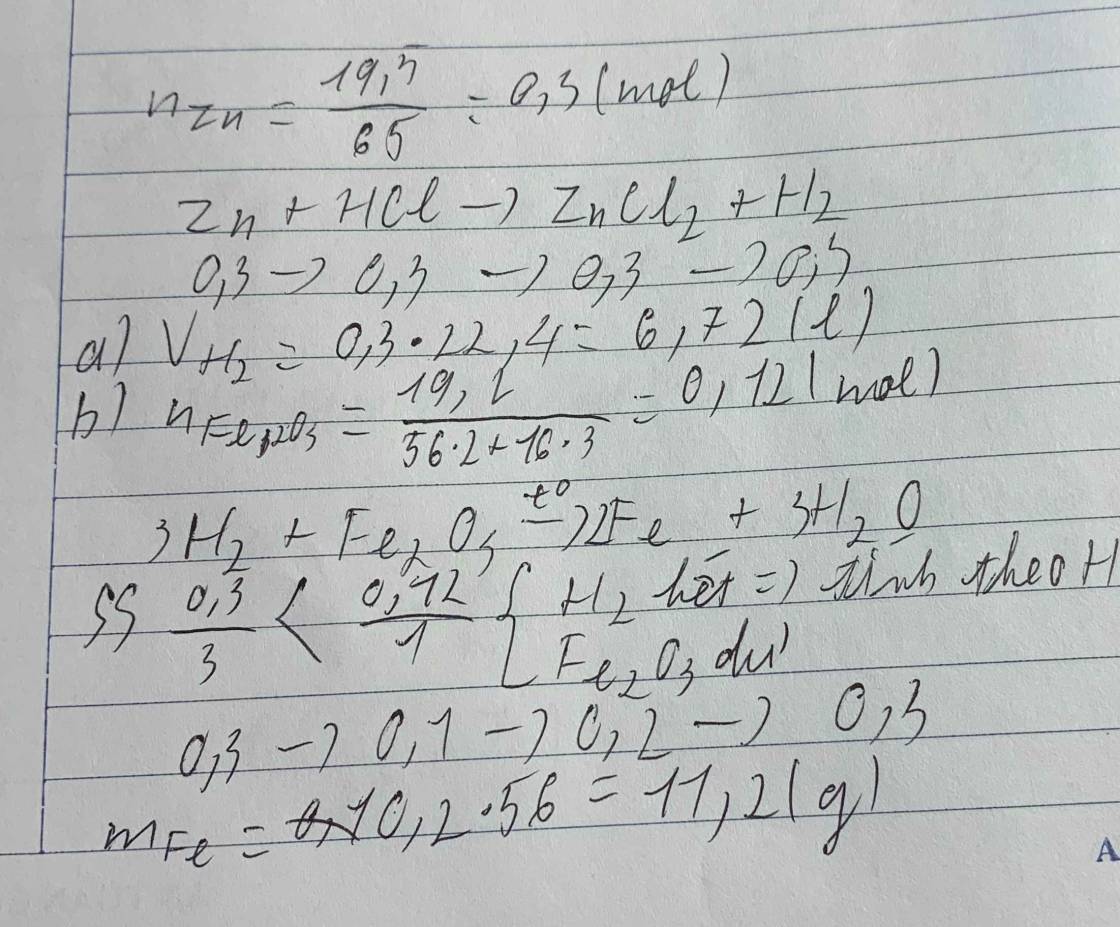
a, \(n_{Al}=\dfrac{2,7}{27}=0,1\left(mol\right)\)
PT: \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
Theo PT: \(n_{H_2}=\dfrac{3}{2}n_{Al}=0,15\left(mol\right)\Rightarrow V_{H_2}=0,15.22,4=3,36\left(l\right)\)
b, Có lẽ đề hỏi bao nhiêu gam đồng thay vì "bao nhiêu gam sắt" bạn nhỉ?
\(n_{CuO}=\dfrac{20}{80}=0,25\left(mol\right)\)
PT: \(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
Xét tỉ lệ: \(\dfrac{0,25}{1}>\dfrac{0,15}{1}\), ta được CuO dư.
Theo PT: \(n_{Cu}=n_{H_2}=0,15\left(mol\right)\Rightarrow m_{Cu}=0,15.64=9,6\left(g\right)\)