Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

31 / Cả A và D đều ko kết tủa
36/ C vì Na2O + HCl -> NaCl + H2O
37/ D vì Ag yếu hơn H2 nên ko đẩy đc
49/ mình ko biết làm :((
50/ 2Fe(OH)3 -> Fe2O3 + 3H2O
=> Fe2O3 là chất rắn
số mol của Fe2O3 là : n = m / M = 24 / ( 56*2 + 16*3 ) = 24 / 160 = 0,15 mol
Theo pthh =>> số mol của Fe(OH)3 là : 0,15 * 2 = 0,3 mol
khối lượng của Fe(OH)3 là : m = n*M = 0,3 * ( 56+ 17*3) = 0,3 * 107 = 32,1 gam
=>> x = 32,1 gam
hình như là sai đáp án cho sai rồi bạn

1. Cặp chất nào dưới đây phản ứng với nhau để tạo thành hợp chất khí?
|
A. Kẽm với axit clohiđric. |
B. Natri hiđroxit và axit clohiđric. |
|
C. Natri cacbonat và Canxi clorua. |
D. Natri cacbonat và axit clohiđric. |
2. Dãy các chất đều tác dụng được với dung dịch BaCl2:
|
A. Fe, Cu, CuO, SO2, NaOH, CuSO4. |
B. NaOH, CuSO4. |
|
C. Fe, Cu, HCl, NaOH, CuSO4. |
D. H2SO4 loãng, CuSO4. |
3. Cho dung dịch X vào dung dịch Y thu được kết tủa trắng, kết tủa không tan trong dung dịch axit HCl. Dung dịch X và Y là của các chất :
|
A. BaCl2 và Na2CO3. |
B. NaOH và CuSO4 |
C. Ba(OH)2 và Na2SO4. |
D. BaCO3 và K2SO4. |
4. Có hỗn hợp gồm nhôm oxit và bột sắt oxit, có thể tách được sắt oxit bằng cách cho tác dụng với một lượng dư dung dịch:
|
A. HCl. |
B. NaCl. |
C. KOH. |
D. HNO3. |
5. Dãy gồm các chất đều phản ứng với axit sunfuric loãng là:
|
A. NaOH, Cu, CuO. |
B. Cu(OH)2, SO3, Fe. |
C. Al, Na2SO3. |
D. NO, CaO. |
6. Cho bột Đồng qua dung dịch axit sunfuric đặc, đun nóng. Chất khí sinh ra là:
|
A. H2. |
B. SO3. |
C. SO2 . |
D. CO2. |
7. Cần điều chế một lượng muối đồng sunfat. Phương pháp nào sau đây tiết kiệm được axit sunfuric:
|
A. H2SO4 tác dụng với CuO. |
B. H2SO4 đặc tác dụng với Cu. |
|
C. Cu tác dụng với H2SO4loãng. |
D. Cả B và C đều đúng. |
8. Axit nào tác dụng được với Mg tạo ra khí H2:
|
A. H2SO4đặc, HCl. |
B. HNO3(l), H2SO4(l). |
|
C. HNO3đặc, H2SO4 đặc. |
D. HCl, H2SO4(l). |
9. Khi cho CO có lẫn CO2, SO2 có thể làm sạch khí CO bằng những chất nào:
|
A. H2O. |
B. dd HCl. |
C. dd NaOH. |
D. dd H2SO4. |
10. Dùng thuốc thử nào có thể phân biệt dược các chất rắn sau: MgO, P2O5, Ba(OH)2, Na2SO4:
|
A. Nước, giấy quỳ tím. |
B. Axit sunfuric loãng, phenolphtalein không màu. |
|
C. Dung dịch NaOH, giấy quỳ tím. |
D. Tất cả đều sai. |
11. Dãy gồm các chất là oxit bazơ:
|
A. Al2O3, CaO, CuO. |
B. CaO, Fe2O3, Mn2O7 . |
C. SiO2, Fe2O3, CO. |
D. ZnO, Mn2O7, Al2O3. |
12. Hãy chọn thuốc thử để nhận biết các dung dịch sau: NaOH, H2SO4, HCl, Na2SO4, NaCl:
|
A. dd BaCl2 và quỳ tím. |
B. Phenolphtalein không nàu và dd AgNO3. |
|
C. CaCO3 và dd phenolphtalein không màu. |
D. A, B đều đúng. |

Giải
| Có liên kết đôi | Làm mất màu dd Brom | Phản ứng trùng hợp | Tác dụng với oxi | |
| Metan | không | không | không | có |
| Etilen | có 1 liên kết đôi | có | có | có |


Phương trình hóa học của các phản ứng:
Pb(NO3)2 + Na2CO3 → 2NaNO3 + PbCO3↓
Pb(NO3)2 + 2KCl → 2KNO3 + PbCl2↓
Pb(NO3)2 + Na2SO4 → 2NaNO3 + PbSO4↓
BaCl2 + NaCO3 → 2NaCl + BaCO3↓
BaCl2 + Na2SO4 → 2NaCl + BaSO4↓
| Na2CO3 | KCl | Na2SO4 | NaNO3 | |
| Pb(NO3)2 | x | x | x | o |
| BaCl2 | x | o | x | o |
Phương trình hóa học của các phản ứng:
Pb(NO3)2 + Na2CO3 → PbCO3 ↓ + 2NaNO3
Pb(NO3)2 + 2KCl → PbCl2 ↓ + 2KNO3
Pb(NO3)2 + Na2SO4 → PbSO4 ↓ + 2NaNO3
BaCl2 + Na2CO3 → BaCO3 ↓ + 2NaCl
BaCl2 + Na2SO4 → BaSO4 ↓ + 2NaCl.

Các thầy cô Quản Lý OLM ơi , Nick con Là : Lê + Trường+ Giang +™❖t̠r̠ưởn̠g̠๖t̠e̠a̠m̠+ ( ✎﹏TΣΔM ΔΠGΣLS ΩҒ DΣΔTH )ᵛᶰシ+( ✎﹏TΣΔM FAシ)
Con làm đơn này để xin các thầy cô Quản Lý OLM mở lại cho con để con cùng đồng hành với nhưng ngươì bạn của con trên Nick Lê + Trường+ Giang +™❖t̠r̠ưởn̠g̠๖t̠e̠a̠m̠+ ( ✎﹏TΣΔM ΔΠGΣLS ΩҒ DΣΔTH )ᵛᶰシ+( ✎﹏TΣΔM FAシ) ạ !!
CỘNG HÒA XÃ HỘI CHỦ NGHĨA VIỆT NAM
Độc lập - Tự do - Hạnh phúc
BẢN KIỂM ĐIỂM
Kính gửi : (1) Các thầy, cô ban Quản Lý OLM
Họ và tên học sinh:Lê Ngọc Long
Lớp 7A2 - THCS Sài Đồng Năm học: 2021 - 2022
Sinh ngày :7 tháng 6 năm 2009
Nay em tự viết bản kiểm điểm trình bày về khuyết điểm của em như sau:
Con là Lê Ngọc Long , con làm đơn này để kiểm điểm lại việc con bị khóa nick ạ :
- Người đăng câu hỏi lung tung không phải anh con và dùng những từ ngữ bậy trên phần Diễn Đàn của OLM .VN ạ
- 1 lúc sau con vào lại thì bị khóa nick , anh con cũng đã xin lỗi con nhưng con rất buồn khi thấy nick con đã bị khóa . Con xin Các thầy cô Quản lý OLM giúp con mở lại nick cho con để con có thể nói chuyện cũng như học tập cùng các bạn trên đó ạ
Lời Hưa :
Con sẽ chịu hình phạt khóa nick thêm 1 lần nữa nếu con và anh con tiếp tục đăng câu trả lờ có những từ bậy bạ ạ
Con sẽ không bao giờ tái phạm 1 lần nữa
Mong các thầy cô Quản Lý OLM.VN mở lại nick Lê + Trường+ Giang +™❖t̠r̠ưởn̠g̠๖t̠e̠a̠m̠+ ( ✎﹏TΣΔM ΔΠGΣLS ΩҒ DΣΔTH )ᵛᶰシ+( ✎﹏TΣΔM FAシ) : tên đăng nhập : truonggiang88
Con chân thành cảm ơn các thầy, cô Ban Quản Lý OLM .Vn ạ
ngày. 30 tháng .9 .năm.2021
Người viết (Ký, ghi rõ họ, tên) |
Long
Lê Ngọc Long

a. PTHH: \(2SO_2+O_2\rightarrow^{t^o}_{V_2O_5}2SO_3\) (đoạn này Latex OLM đánh nhiều hơi rối nên không hiểu thì hỏi nhé)
\(SO_3+H_2O\rightarrow H_2SO_4\)
\(300ml=0,3l\)
\(\rightarrow n_{H_2SO_4}=1.0,3=0,3mol\)
Theo phương trình \(n_{O_2}=n_{SO_3}=n_{H_2SO_4}=0,3mol\)
\(\rightarrow m_{SO_2}=64.0,3=19,2g\)
b. PTHH: \(Al_2O_3+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2O\)
\(n_{Al_2O_3}=\frac{15,3}{102}=0,15mol\)
Xét tỉ lệ \(n_{Al_2O_3}>\frac{n_{H_2SO_4}}{3}\)
Vậy \(Al_2O_3\) dư
Theo phương trình \(n_{Al_2\left(SO_4\right)_3}=\frac{1}{3}n_{H_2SO_4}=0,1mol\)
\(\rightarrow C_{M_{Al_2\left(SO_4\right)_3}}=\frac{0,1}{0,3}=0,33M\)
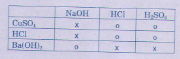

- HCl pư được với các oxit bazơ.
→ Đáp án: C.