Bài 2 : Cho 1 (g) bột Fe phản ứng với Oxi , một thời gian thu được 1,24 (g) hỗn hợp Fe2O3 và Fe dư. Tính khối lượng Fe dư.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


4Fe+3O2\(\rightarrow\)2Fe2O3
Bảo toàn khối lượng mFe ban đầu +mO2=mFe2O3+mFe dư
\(\rightarrow\)1+32nO2=1,24
\(\rightarrow\)nO2=0,0075mol
\(\rightarrow\)nFe phản ứng=\(\frac{4nO2}{3}\)=\(\frac{\text{4.0,0075}}{3}\)=0,01mol
\(\rightarrow\)mFe phản ứng=0,01.56=0,56mol
\(\rightarrow\)Khối lượng Fe dư=1-0,56=0,44g

a) Ta có: nH2=4,48/22,4=0,2(mol)
PTHH: Fe +2 HCl -> FeCl2 + H2
0,2________0,4______0,2__0,2(mol)
mFe=0,2.56=11,2(g)
=> %mFe= (11,2/17,6).100=63,636%
=> %mCu= 36,364%
b) Fe2O3 + 3 H2 -to-> 2 Fe + 3 H2O
Ta có: nH2=0,2(mol) => nFe=2/3. 0,2= 2/15(mol)
=> mFe= 2/15 . 56=7,467(g)
Số moll của khí hidro ở dktc
nH2 = \(\dfrac{V_{H2}}{22,4}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Pt : Fe + 2HCl → FeCl2 + H2\(|\)
1 2 1 1
0,2 0,2
a) Số mol của sắt
nFe = \(\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
Khối lượng của sắt
mFe = nFe . MFe
= 0,2. 56
= 11,2 (g)
Khối lượng của đồng
mCu = 17,6 - 11,2
= 6,4 (g)
0/0Fe = \(\dfrac{m_{Fe}.100}{m_{hh}}=\dfrac{11,2.100}{17,6}=63,64\)0/0
0/0Cu = \(\dfrac{m_C.100}{m_{hh}}=\dfrac{6,4.100}{17,6}=36,36\)0/0
b) 3H2 + Fe2O3 → (to) 2Fe + 3H2O\(|\)
3 1 2 3
0,2 0,13
Số mol của sắt
nFe = \(\dfrac{0,2.2}{3}=0,13\left(mol\right)\)
Khối lượng của sắt
mFe = nFe . MFe
= 0,13 . 56
= 7,28 (g)
Chúc bạn học tốt

Đáp án D
Các phản ứng xảy ra:
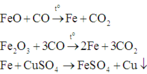
Hỗn hợp rắn thu được khi cho hỗn hợp phản ứng với dung dịch CuSO4 gồm Cu, FeO và Fe2O3.
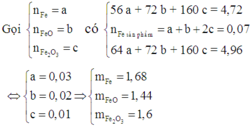

Cho 4,72 gam hỗn hợp bột gồm các chất Fe, FeO và Fe2O3 tác dụng với CO ở nhiệt độ cao. Phản ứng xong thu được 3,92 gam Fe. Nếu ngâm cùng lượng hỗn hợp các chất trên trong dung dịch CuSO4 dư, phản ứng xong khối lượng chất rắn thu được là 4,96 gam. Khối lượng (gam) Fe, Fe2O3 và FeO trong hỗn hợp ban đầu lần lượt là
A. 1,68; 1,44; 1,6
B. 1,6; 1,54; 1,64

Coi hh gồm Fe và O.
Ta có: 56nFe + 16nO = 14,64 (1)
Ta có: \(n_{NO}=\dfrac{1,4874}{24,79}=0,06\left(mol\right)\)
Theo ĐLBT e, có: 3nFe = 2nO + 3nNO ⇒ 3nFe - 2nO = 0,06.3 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Fe}=0,201\left(mol\right)\\n_O=0,2115\left(mol\right)\end{matrix}\right.\)
⇒ m = mFe = 0,201.56 = 11,256 (g)

Đáp án B
Xét giai đoạn A tác dụng với H2SO4 đặc, nóng, dư:
Số mol SO2 thu được là: n SO 2 = 0 , 15 mol
Qui đổi hỗn hợp A thành Fe : a mol; O : b mol
![]()
Sơ đồ phản ứng :
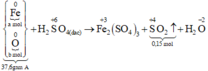
Các quá trình nhường, nhận electron:
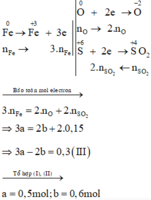
Xét giai đoạn để m gam Fe ngoài không khí:
Sơ đồ phản ứng :


Số mol của khí hidro ở dktc
nH2 = \(\dfrac{V_{H2}}{22,4}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Pt : Fe + 2HCl → FeCl2 + H2\(|\)
1 2 1 1
0,2 0,2
a) Số mol của sắt
nFe = \(\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
Khối lượng của sắt
mFe = nFe .MFe
= 0,2. 56
= 11,2 (g)
Khối lượng của đồng
mCu = 17,6 - 11,2
= 6,4 (g)
0/0Fe = \(\dfrac{m_{Fe}.100}{m_{hh}}=\dfrac{11,2.100}{17,6}=63,64\)0/0
0/0Cu = \(\dfrac{m_{Cu}.100}{m_{hh}}=\dfrac{6,4.100}{17,6}=36,36\)0/0
b) 3H2 + Fe2O3 → (to) 2Fe + 3H2O\(|\)
3 1 2 3
0,2 0,13
Số mol của sắt
nFe = \(\dfrac{0,2.2}{3}=0,13\left(mol\right)\)
Khối lượng của sắt
mFe = nFe . MFe
= 0,13 . 56
= 7,28 (g)
Chúc bạn học tốt
Bài 2 : Cho 1 (g) bột Fe phản ứng với Oxi , một thời gian thu được 1,24 (g) hỗn hợp Fe2O3 và Fe dư.
Tính khối lượng Fe dư.
#