Đốt cháy hoàn toàn 21.6g hỗn hợp bột Fe và Mg, có tỉ lệ số mol nFe :nMg = 3:2 trong khí oxi
a) Tính khối lượng mỗi oxit thu được.
b) Tính thể tích oxi đã tham gia phản ứng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đặt nFe = a (mol) , nMg = b(mol)
=> 2a - 3b = 0 (1)
Lại có: 56a + 24b = 21,6 (2)
Giải (1) và (20 => a = 0,3 và b = 0,2
Bảo toàn nguyên tố Fe:
nFe3O4 = nFe / 3 = 0,1 (mol)
=> mFe3O4 = 23,2(g)
Bảo toàn nguyên tố Mg:
nMgO = nMg = 0,2 (mol)
=> mMgO = 20,4(g)
Bảo toàn nguyên tố O:
2nO2 = 4nFe3O4 + nMgO
=> nO2 = 0,3(mol)
=> VO2 = 6,72(l)

Đáp án B.
Bảo toàn khối lượng:
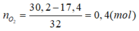
=> V = 0,4.22,4 = 8,96 (lít)

Chọn A
Bảo toàn khối lượng: moxi = 15,1 – 8,7 = 6,4 → noxi = 0,2 mol
→ V = 0,2.22,4 = 4,48 lít.

Bảo toàn khối lượng: m oxi = 30 , 2 – 17 , 4 = 12 , 8 → n oxi = 0 , 4 mol
→ V = 0,4.22,4 = 8,96 lít.
Chọn đáp án B.

Đáp án : D
Bảo toàn khối lượng => mO2 phản ứng = 30,2 – 17,4 = 12,8g
=> nO2 = 0,4 mol => V = 8,96lit
a)
Gọi n Fe = 3a(mol) ; n Mg = 2a(mol)
Suy ra :
3a.56 + 2a.24 = 21,6
=> a = 0,1
Vậy : n Fe = 0,3 ; n Mg = 0,2(mol)
$3Fe + 2O_2 \xrightarrow{t^o} Fe_3O_4$
$2Mg + O_2 \xrightarrow{t^o} 2MgO$
n Fe3O4 = 1/3 n Fe = 0,1(mol) => m Fe3O4 = 0,1.232 = 23,2(gam)
n MgO = n Mg = 0,2(mol) => m MgO = 0,2.40 = 8(gam)
b)
n O2 = 2/3 n Fe + 1/2 n Mg = 0,3(mol)
V O2 = 0,3.22,4 = 6,72 lít