cho hai hỗn hợp 2 kim loại 2,4 Mg và 6,4 Cu vào dung dịch H2SO4 dư
tính thể tích của h2 thoát ra ở đkc 25 độ c một atmosphere
giúp mình với ạ
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

HD:
Thí nghiệm 1 chỉ có Na phản ứng:
Na + HOH \(\rightarrow\) NaOH + 1/2H2 (1)
0,4 0,2 mol
Thí nghiệm 2 chỉ có Al phản ứng (kim loại lưỡng tính):
Al + OH- + H2O \(\rightarrow\) AlO2- + 3/2H2 (2)
0,7/3 0,35 mol
Thí nghiệm 3 cả 3 chất đều phản ứng:
2Na + H2SO4 \(\rightarrow\) Na2SO4 + H2 (3)
Mg + H2SO4 \(\rightarrow\) MgSO4 + H2 (4)
2Al + 3H2SO4 \(\rightarrow\) Al2(SO4)3 + 3H2 (5)
Gọi x, y, z tương ứng là số mol của Na, Mg và Al trong a gam hh.
Ta có: x = 0,4 mol; z = 0,7/3 mol; x/2 + y + 3z/2 = 0,5. Suy ra: y = -0.5 < 0 (vô lí)
Bạn xem lại đề bài, đề bài ko đúng.

vì đề không nói là H2SO4 đặc nóng nên mình coi là đặc nguội nha. H2SO4 đặc nguội thụ động với Fe nên không xảy ra phản ứng.

Đáp án C
Trong 15,2 gam hỗn hợp kim loại
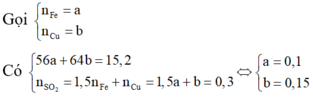
Do đó trong 1,52 gam hỗn hợp kim loại có 0,01 mol Fe.
Khi hòa tan 1,52 gam hỗn hợp kim loại vào dung dịch H2SO4 loãng dư thì nH = nF = 0,01
⇒ V H 2 = 0 , 224 ( lít )

Ta có nH2 = 3,36/22,4 = 0,15 mol
Fe +2 HCl -> FeCl2 + H2
0,15. 0,3 <-. 0,15. ( Mol)
=> mFe = 0,15 × 56 = 8,4g
=> %Fe = 8,4/15×100% = 56%
=> %Cu = 100% - 56% = 44%
=>VHCl =1\0,3=10\3 l

PTHH: Mg + 2HCl → MgCl2 + H2 ↑
Fe + 2HCl → FeCl2 + H2 ↑
2Al + 6HCl → 2AlCl3 + 3H2 ↑
Gọi số mol của H2 thoát ra do Al là 2a => số mol H2 thoát ra do Mg là a (Vì thể tích tỉ lệ thuận vs số mol) , Số mol H2 do Fe thoát ra là b.
Số mol của H2 là: 17,04 : 22,4 = 0,761 mol
Ta có hệ pt:
Khối lượng Fe là: 56b = 56 . 0,4535 = 25,4 gam
Khối lượng Mg là: 24a = 1,85 gam
Khối lượng Al là: 27 . 2a = 4,15 gam

m(rắn)=mCu=6,4(g)
nH2=6,72/22,4=0,3(mol)
PTHH: Mg + H2SO4 -> MgSO4+ H2
nMg=nH2=0,3(mol)
=>a=m(hhCu,Mg)=mCu+mMg=6,4+0,3.24= 13,6(g)
=>a=13,6(g)
Chúc em học tốt!

\(n_{Mg}=a;n_{Fe}=0,5a;n_{Zn}=b\\ a\left(24+28\right)+65b=52a+65b=44,2\\ 1,5a+b=\dfrac{24,64}{22,4}1,1\\ a=0,6;b=0,2\\ \%m_{Mg}=\dfrac{24a}{44,2}=32,58\%\\ \%m_{Fe}=\dfrac{28a}{44,2}=38\%\\ \%m_{Zn}=29,42\%\\ m_{ddacid}=\dfrac{98\left(1,5a+b\right)}{0,08}=1347,5g\\ m_{ddsau}=1389,5g\\ C\%_{MgCl_2}=\dfrac{95a}{1389,5}=4,10\%\\ C\%_{FeCl_2}=\dfrac{127.0,5a}{1389,5}=2,74\%\\ C\%_{ZnCl_2}=\dfrac{136b}{1389,5}=1,96\%\)

\(n_{HCl}=0,3.2=0,6\left(mol\right)\\ m_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\\ PTHH:Fe+2HCl\rightarrow FeCl_2+H_2\\ Vì:\dfrac{0,2}{1}< \dfrac{0,6}{2}\Rightarrow HCldư\\ n_{H_2}=n_{Fe}=0,2\left(mol\right)\\ V_{H_2\left(đkc\right)}=24,79.0,2=4,958\left(l\right)\)

a)
\(n_{H_2}=\dfrac{9,916}{24,79}=0,4\left(mol\right)\)
PTHH: Zn + H2SO4 --> ZnSO4 + H2
_____0,4<---0,4<--------0,4<----0,4
=> mZn = 0,4.65 = 26 (g)
=> \(\left\{{}\begin{matrix}\%Zn=\dfrac{26}{51,6}.100\%=50,388\%\\\%Cu=\dfrac{51,6-26}{51,6}.100\%=49,612\text{%}\end{matrix}\right.\)
b)
mZnSO4 = 0,4.161 = 64,4 (g)
c)
\(V_{ddH_2SO_4}=\dfrac{0,4}{2}=0,2\left(l\right)\)
$\rm n_{Mg}=\dfrac{2,4}{24}=0,1(mol)$
$\rm n_{Cu}=\dfrac{6,4}{64}=0,1(mol)$
Phương trình hóa học
$\rm Mg +H_2SO_4 \to MgSO_4 +H_2$
$\rm Cu$ không tác dụng với $\rm H_2SO_4$ loãng
$\rm n_{H_2}=n_{Mg}=0,1(mol)$
$\rm V_{H_2}=0,1.24,79=2,479(l)$