Một nguyên tử kim loại X có tổng số hạt proton, neutron, electron là 58. Xác định số hạt mỗi loại của nguyên tử X. Cho biết số p, số e, số n trong nguyên tử.
GIÚP MIK NHA!
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

`#3107.101107`
a.
Gọi số hạt proton, neutron, electron trong nguyên tử X lần lượt là `p, n, e`
Tổng số hạt trong nguyên tử X là `48`
`=> p + n + e = 48`
Mà trong nguyên tử, số `p = e`
`=> 2p + n = 48`
Mà số hạt `p = n`
`=> 3p = 48`
`=> p = 48 \div 3`
`=> p = 16`
Vậy, số `p = n = e = 16`
b.
Khối lượng nguyên tử X là: `16 + 16 = 32` (amu)
c.
Bạn tham khảo mô hình NT X:
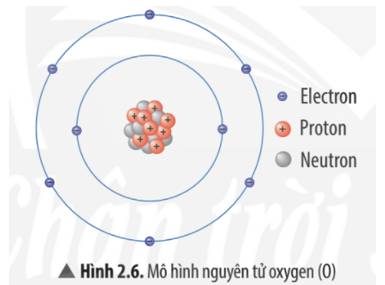
- X có `3` lớp electron
- X có `6` electron lớp ngoài cùng.

Gọi p là số proton
Gọi n là số nơ tron
Gọi e là số electron
Theo đề bài ta có :
p+n+e=58 và p+n<40
Ta thấy p+n=39<40 (số khối hay Khối lượng nguyên tử) ⇒ n=58-39=19 electron (lớp 1 : 2 electron; lớp 2 : 8 electron; lớp 3: 8 electron; lớp 4 : 1 electron)
⇒ Nguyên tử đó có 4 lớp electron và lớp ngoài cùng có 1 electron ⇒ Thuộc chu kỳ 4 và Nhóm IA
Vậy nguyên tử đó là K (Protassium) và số hiệu nguyên tử là 19

\(p+e+n=36\)
mà \(p+e=2n\)
\(\Rightarrow2n+n=36\)
\(\Rightarrow3n=36\)
\(\Rightarrow n=12\)
\(\Rightarrow p+e=24\)
mà \(p=e\)
\(\Rightarrow p=e=24:2=12\)

Ta có: P + N + E = 18
Mà: P = E (do nguyên tử trung hòa về điện)
⇒ 2P + N = 18 ⇒ N = 18 - 2P
Luôn có: \(1\le\dfrac{N}{P}\le1,5\) \(\Rightarrow P\le18-2P\le1,5P\)
\(\Rightarrow5,14\le P\le6\)
⇒ P = E = 6
N = 6

Số hạt mang điện tích ( p và e ).
( 34 + 10 ) : 2 = 22 ( hạt ).
Mà p = e
=> p = e = 22 : 2 = 11 ( hạt ).
Số hạt không mang điện tích ( n )
22 - 10 = 12 ( hạt )
Vậy nguyên tử đó có p = 11 ; e = 11 ; n = 12.
Số hạt mang điện tích ( p và e ).
( 34 + 10 ) : 2 = 22 ( hạt ).
Mà p = e
=> p = e = 22 : 2 = 11 ( hạt ).
Số hạt không mang điện tích ( n )
22 - 10 = 12 ( hạt )
Vậy nguyên tử đó có p = 11 ; e = 11 ; n = 12.

ta co p+e+n=93 mà p=e=z => 2z+n=93
2z-n=23 ( vì số hạt mang điện nhiều hơn số hạt ko mang điện là 23)
tu 2 pt trên ta có z =29,,n=35
=> số hiệu nguyên tử của B = Z = 29
cấu hình electron
\(1s^22s^22p^63s^23p^64s^23d^9\)
đối với các dạng bài này , bạn cần nhớ kiến thức như sau :
Tổng số hạt trong nguyên tử = 2p + n ( gồm có 3 loại hạt : n , p, e trong đó p=e)
số hạt mang điện là 2p
số hạt không mang điện là n
số hiệu nguyên tử là Z= p = e = số thứ tự nhóm .
Sau khi xác định được p ,, tức là cũng xác định được e thì
cấu hình viết theo dãy trật tự các mức năng lượng
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10.......
Các nguyên tử có 1, 2, 3e ở lớp ngoài cùng là các nguyên tử kim loại, trừ H, He và B.Các nguyên tử có 5, 6, 7e ở lớp ngoài cùng thường là các nguyên tố phi kim. Các nguyên tử có 4e ở lớp ngoài cùng có thể là nguyên tử kim loại hoặc phi kim
Theo đề, ta có: \(2Z+N=58\)
=>N=58-2Z
Z<=N<=1,52Z
=>Z<=58-2Z<=1,52Z
Z<=58-2Z
=>3Z<=58
=>\(Z\in\left\{1;2;3;...;19\right\}\)
58-2Z<=1,52Z
=>58<=3,52Z
=>3,52Z>=58
=>\(Z>=\dfrac{58}{3,52}\)
mà Z nguyên
nên Z>=16,47
=>\(Z\in\left\{17;18;19\right\}\)
Nếu Z=17 thì X là Clo, là phi kim
=>Loại
Nếu Z=18 thì X là argon, không phải kim loại
=>Loại
Nếu Z=19 thì X là Kali
=>Nhận
Vậy: Z=19; \(N=58-2\cdot19=58-38=20\)
tk ạ
p=19𝑝=19
e=19𝑒=19
n=20𝑛=20
Giải thích các bước giải:
Tổng hạt trong X là p+n+e=58𝑝+𝑛+𝑒=58
Mà p=e𝑝=𝑒
→2p+n=58→2𝑝+𝑛=58
→n=58−2p→𝑛=58-2𝑝
Có p≤n≤1,5p→p≤58−2p≤1,5p→16,6≤p≤19,33𝑝≤𝑛≤1,5𝑝→𝑝≤58−2𝑝≤1,5𝑝→16,6≤𝑝≤19,33
Xét p=17→e=17;n=24→A=41𝑝=17→𝑒=17;𝑛=24→𝐴=41 loại.
Xét p=18→e=18;n=22→A=40𝑝=18→𝑒=18;𝑛=22→𝐴=40 loại.
Xét p=19→e=19;n=20→A=39𝑝=19→𝑒=19;𝑛=20→𝐴=39 nhận.
Vậy p=e=19;n=20𝑝=𝑒=19;𝑛=20