Để đốt cháy hoàn toàn 24 lit CH4 cần dùng bao nhiêu lit không khí? Biết Oxi chiếm 20% thể tích không khí và các khí đo ở cùng điều kiện nhiệt độ, áp suất. *
A. 48 lit.
B. 24 lit
C. 240 lit.
D. 120 lit
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(V_{O_2}=\dfrac{336}{5}=67,2\left(ml\right)=0,0672\left(l\right)\\ n_{O_2}=\dfrac{0,0672}{22,4}=0,003\left(mol\right)\\ CH_4+2O_2\rightarrow\left(t^o\right)CO_2+2H_2O\\ n_{CO_2}=n_{CH_4}=\dfrac{0,003}{2}=0,0015\left(mol\right)\\ a,V_{CH_4\left(đktc\right)}=0,0015.22,4=0,0336\left(l\right)\\ b,V_{CO_2\left(đktc\right)}=V_{CH_4\left(đktc\right)}=0,0336\left(l\right)\)

a, \(C_2H_4+3O_2\underrightarrow{t^o}2CO_2+2H_2O\)
Ta có: \(n_{C_2H_4}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
Theo PT: \(n_{O_2}=3n_{C_2H_4}=1,5\left(mol\right)\Rightarrow V_{O_2}=1,5.22,4=33,6\left(l\right)\)
b, \(V_{kk}=\dfrac{V_{O_2}}{20\%}=168\left(l\right)\)

PTHH: \(C_2H_4+3O_2\underrightarrow{t^o}2CO_2+2H_2O\)
\(n_{C_2H_4}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
Theo PTHH: \(n_{O_2}=3.n_{C_2H_4}=3.0,5=1,5\left(mol\right)\)
=> \(V_{O_2\left(đktc\right)}=1,5.22,4=33,6\left(l\right)\)
câu b oxi chiếm bao nhiêu của kk vậy bạn

\(n_{CH_4}=\dfrac{3,36}{22,4}=0,15mol\)
\(CH_4+2O_2\underrightarrow{t^o}CO_2+2H_2O\)
0,15 0,3
\(V_{O_2}=0,3\cdot22,4=6,72l\)
\(\Rightarrow V_{kk}=5V_{O_2}=5\cdot6,72=33,6l\)
Không có đáp án đúng!

Ta thấy tỉ lệ về thể tích cùng là tỉ lệ về số mol:
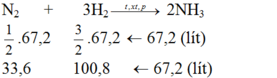
Tỉ lệ số mol cũng chính là tỉ lệ thể tích
Theo pt:
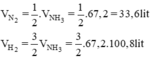
Do hiệu suất của phản ứng là 25% nên thể tích của nitơ và hiđro cần lấy là:
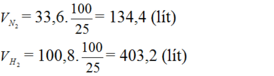

nCH4 = 6.72: 22,4 = 0.3 (mol)
a)
PTHH CH4 + 2O2 → CO2 + 2H2O
1 2 1 2 (mol)
0,15 0,3 0,15 0,3
b)
VO2 = n.22,4 = 0,6 . 22,4 = 13.44 (l)
⇒V kk = V O2 . 5 = 13.44 . 5 = 67.2 (l)
PT: \(CH_4+2O_2\underrightarrow{t^o}CO_2+2H_2O\)
Ta có: \(n_{CH_4}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Theo PT: \(\left\{{}\begin{matrix}n_{CO_2}=n_{CH_4}=0,3\left(mol\right)\\n_{O_2}=n_{H_2O}=2n_{CH_4}=0,6\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m_{CO_2}=0,3.44=13,2\left(g\right)\)
\(m_{H_2O}=0,6.18=10,8\left(g\right)\)
\(V_{O_2}=0,6.22,4=13,44\left(l\right)\Rightarrow V_{kk}=13,44.5=67,2\left(l\right)\)
Bạn tham khảo nhé!

Ta có nH=5:22,4=\(\frac{25}{112}\) mol
pthh:4H+O2\(\rightarrow\)2H2O
\(\Rightarrow\)nO2= \(\frac{1}{4}.\frac{25}{112}=\frac{25}{448}\) MOL
VO2=\(\frac{25}{448}.22,4=1,25\) lít
vì VO2=\(\frac{1}{5}\)Vkk\(\Rightarrow\) 1,25.5=6,25(lít)
vậy Vkk=6,25 lít
chúc bạn học tốt like mình nha![]()

Các khí đo ở cùng điều kiện nhiệt độ , áp suất thì tỉ lệ về thể tích cũng là tỉ lệ về số mol
C8H18 + 25/2O2 --> 8CO2 + 9H2O
Theo pt : 1 25/2 8 9 (lít)
Theo đề bài 8 <------100
Theo đề bài 240 ------> 3000
Vậy thể tích khí C8H18 cháy trong 500l không khí tức 100 lít Oxi là 8 lít,
Thể tích oxi cần dùng để đốt cháy hết 240 lít C8H18 là 3000 lít
\(CH_4+2O_2\underrightarrow{^{t^0}}CO_2+2H_2O\)
\(24.........48\)
\(V_{O_2}=48\left(l\right)\)
\(V_{kk}=5V_{O_2}=5\cdot48=240\left(l\right)\)
Ở cùng điều kiện nhiệt độ và áp suất, tỉ lệ số mol cũng là tỉ lệ thể tích.
PT: \(CH_4+2O_2\underrightarrow{t^o}CO_2+2H_2O\)
____24___48 (lít)
Mà: VO2 = 20%Vkk
\(\Rightarrow V_{kk}=\dfrac{48}{20\%}=240\left(l\right)\)
⇒ Đáp án: C
Bạn tham khảo nhé!