hoà tan 20,4 Al2O3 vào 500 ml dung dịch HCl 4M
a) tính khối lượng acid đã phản ứng , chất nào dư và dư với khối lượng bao nhiêu
b) tính khối lượng muối tạo thành sau phản ứng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{FeO}=\dfrac{14,4}{72}=0,2\left(mol\right)\)
\(m_{ct}=\dfrac{10,95.200}{100}=21,9\left(g\right)\)
\(n_{HCl}=\dfrac{21,9}{36,5}=0,6\left(mol\right)\)
Pt : \(FeO+2HCl\rightarrow FeCl_2+H_2O|\)
1 2 1 1
0,2 0,6 0,2
a) Lập tỉ số so sánh : \(\dfrac{0,2}{1}< \dfrac{0,6}{2}\)
⇒ FeO phản ứng hết , HCl dư
⇒ Tính toán dựa vào số mol của FeO
\(n_{HCl\left(dư\right)}=0,6-\left(0,2.2\right)=0,2\left(mol\right)\)
⇒ \(m_{HCl\left(dư\right)}=0,2.36,5=7,3\left(g\right)\)
b) \(n_{FeCl2}=\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
⇒ \(m_{FeCl2}=0,2.127=25,4\left(g\right)\)
\(m_{ddspu}=14,4+200=214,4\left(g\right)\)
\(C_{FeCl2}=\dfrac{25,4.100}{214,4}=11,85\)0/0
\(C_{HCl\left(dư\right)}=\dfrac{7,3.100}{214,4}=3,4\)0/0
Chúc bạn học tốt

\(n_{SO_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right);n_{NaOH}=\dfrac{140.20\%}{40}=0,7\left(mol\right)\\ Vì:\dfrac{n_{NaOH}}{n_{SO_2}}=\dfrac{0,7}{0,3}>2\Rightarrow SP:Na_2SO_3.Có:NaOH\left(dư\right)\\ PTHH:2NaOH+SO_2\rightarrow Na_2SO_3+H_2O\\ n_{NaOH\left(dư\right)}=0,7-0,3.2=0,1\left(mol\right)\\ m_{NaOH\left(dư\right)}=0,1.40=4\left(g\right)\\ n_{Na_2SO_3}=n_{SO_2}=0,3\left(mol\right)\\ m_{Na_2SO_3}=126.0,3=37,8\left(g\right)\)

\(n_{Fe}=\dfrac{5,6}{56}=0,1\left(mol\right)\)
\(n_{HCl}=0,1.1=0,1\left(mol\right)\)
PTHH :
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Trc p/u: 0,1 0,1
p/u : 0,05 0,1 0,05 0,05
Sau p/u : 0,05 0 0,05 0,05
-> Fe dư sau p/u
a) \(m_{H_2}=0,05.2=0,1\left(g\right)\)
b) sau p/ư Fe dư
\(m_{Fedư}=0,05.2,8\left(g\right)\)
c) \(m_{FeCl_2}=0,05.\left(56+35,5.2\right)=6,35\left(g\right)\)

a, \(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
\(n_{HCl}=0,1.2=0,2\left(mol\right)\)
PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
Xét tỉ lệ: \(\dfrac{0,2}{1}>\dfrac{0,2}{2}\), ta được Fe dư.
Theo PT: \(n_{H_2}=\dfrac{1}{2}n_{HCl}=0,1\left(mol\right)\Rightarrow V_{H_2}=0,1.22,4=2,24\left(l\right)\)
b, Fe dư.
Theo PT: \(n_{Fe\left(pư\right)}=\dfrac{1}{2}n_{HCl}=0,1\left(mol\right)\Rightarrow n_{Fe\left(dư\right)}=0,2-0,1=0,1\left(mol\right)\)
\(\Rightarrow m_{Fe\left(dư\right)}=0,1.56=5,6\left(g\right)\)
c, \(n_{FeCl_2}=\dfrac{1}{2}n_{HCl}=0,1\left(mol\right)\Rightarrow C_{M_{FeCl_2}}=\dfrac{0,1}{0,1}=1\left(M\right)\)

Số mol: nCO2 = 1,56822,41,56822,4 = 0,07 mol; nNaOH = 6,4406,440 = 0,16 mol
Phương trình hóa học:
2NaOH + CO2 → Na2CO3 + H2O
Lúc ban đầu: 0,07 0,16 0 (mol)
Phản ứng: 0,07 → 0,14 0,07
Sau phản ứng: 0 0,02 0,07
a)Chất còn dư là NaOH và dư: 0,02×40 = 0,8 g
b)Khối lượng muối Na2CO3 tạo thành là: 0,07×106 = 7,42 g.
*TK
$n_{CO_2} = \dfrac{1,568}{22,4} = 0,07(mol) ; n_{NaOH} = \dfrac{6,4}{40} = 0,16(mol)$
$n_{NaOH} : n_{CO_2} = 0,16 : 0,07 = 2,2 > 2$. Do đó, NaOH dư
$2NaOH +C O_2 \to Na_2CO_3 + H_2O$
$n_{Na_2CO_3} = n_{CO_2} = 0,07(mol)$
$m_{Na_2CO_3} = 0,07.106 = 7,42(gam)$
$n_{NaOH\ pư} = 2n_{CO_2} = 0,14(mol)$
$m_{NaOH\ dư} = 6,4 - 0,14.40 = 0,8(gam)$

a)
$n_{Fe} = \dfrac{11,2}{56} = 0,2(mol) ; n_{HCl} = 0,1.2 = 0,2(mol)$
$Fe + 2HCl \to FeCl_2 + H_2$
Ta thấy :
$n_{Fe} : 1 > n_{HCl} : 2$ nên Fe dư
$n_{H_2} = \dfrac{1}{2}n_{HCl} = 0,1(mol)$
$V_{H_2} = 0,1.22,4 = 2,24(lít)$
b)
$n_{Fe\ pư} = n_{H_2} = 0,1(mol)$
$\Rightarrow m_{Fe\ dư} = 11,2 - 0,1.56 = 5,6(gam)$
c)
$n_{FeCl_2} = n_{Fe\ pư} = 0,1(mol)$
$C_{M_{FeCl_2}} = \dfrac{0,1}{0,1} = 1M$

nFe = 5.6/56 = 0.1 (mol)
nHCl = 0.2*2 = 0.4 (mol)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
LTL : 0.1/1 < 0.4/2 => HCl dư
mHCl dư = ( 0.4 - 0.2 ) * 36.5 = 7.3 (g)
VH2 = 0.2*22.4 = 4.48 (l)
CM FeCl2 = 0.1/0.2 = 0.5(M)
CM HCl dư = 0.2 / 0.2 = 1(M)
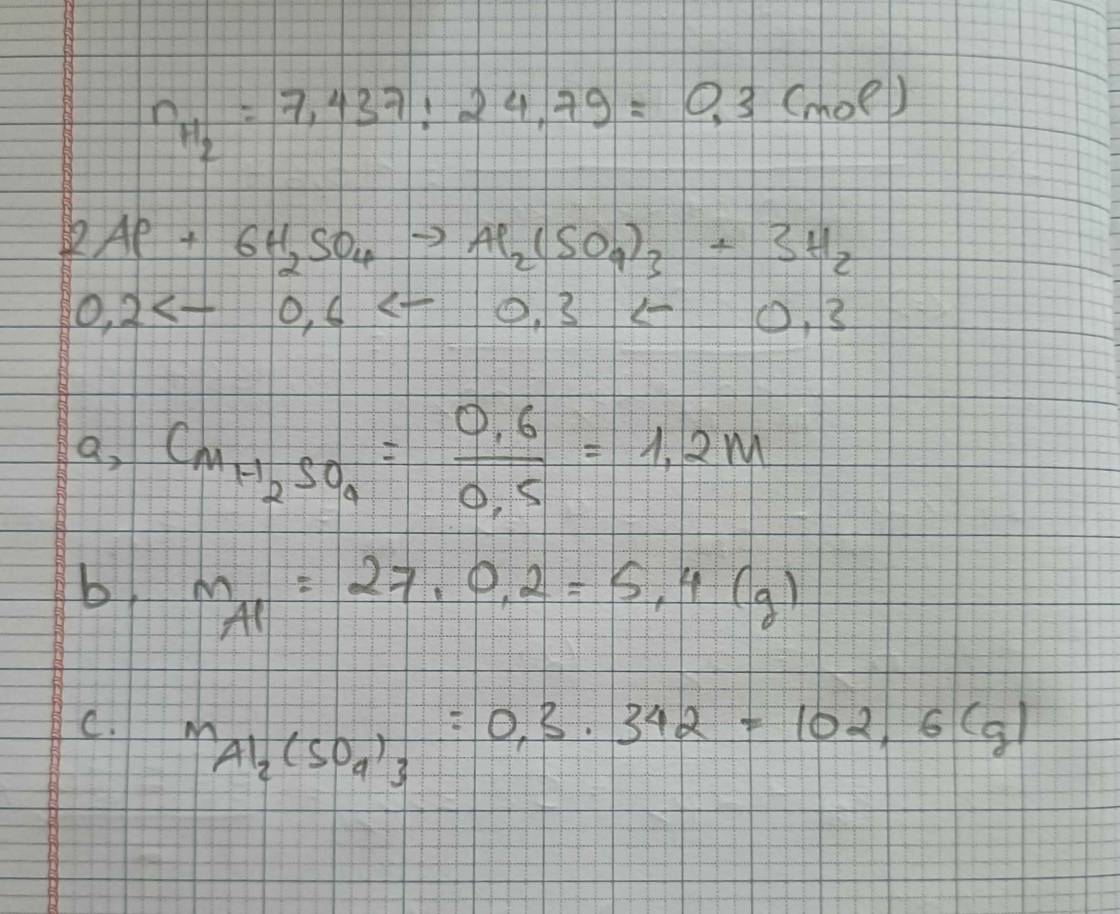
a, \(n_{Al_2O_3}=\dfrac{20,4}{102}=0,2\left(mol\right)\)
\(n_{HCl}=0,5.4=2\left(mol\right)\)
PT: \(Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\)
Xét tỉ lệ: \(\dfrac{0,2}{1}< \dfrac{2}{6}\), ta được HCl dư.
Theo PT: \(n_{HCl\left(pư\right)}=6n_{Al_2O_3}=1,2\left(mol\right)\)
⇒ mHCl (pư) = 1,2.36,5 = 43,8 (g)
nHCl (dư) = 2 - 1,2 = 0,8 (mol)
⇒ mHCl (dư) = 0,8.36,5 = 29,2 (g)
b, \(n_{AlCl_3}=2n_{Al_2O_3}=0,4\left(mol\right)\)
\(\Rightarrow m_{AlCl_3}=0,4.133,5=53,4\left(g\right)\)