Cho 24 g hỗn hợp MgO, Fe2O3 và CuO tác dụng với 250g H2SO4 19,6%. Tính khối lượng muối thu được sau sản phẩm
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án: C
Oxit + H2SO4→ Muối + H2O
0,6 mol 0,6 mol
BTKL: 32+ 0,6.98=mmuối + 0,6.18
mmuối =80 gam

Bài 6 :
a) Pt : \(MgO+H_2SO_4\rightarrow MgSO_4+H_2O|\)
1 1 1 1
a 2a 0,2
\(Al_2O_3+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2O|\)
1 3 1 3
b 3b 0,1
b) Gọi a là số mol của MgO
b là số mol của Al2O3
\(m_{MgO}+m_{Al2O3}=18,2\left(g\right)\)
⇒ \(n_{MgO}.M_{MgO}+n_{Al2O3}.M_{Al2O3}=18,2g\)
⇒ 40a + 102b = 18,2g
Ta có : \(m_{ct}=\dfrac{19,6.250}{100}=49\left(g\right)\)
\(n_{H2SO4}=\dfrac{49}{98}=0,5\left(mol\right)\)
⇒ 1a + 3b = 0,5 (2)
Từ (1),(2), ta có hệ phương trình :
40a + 102b = 18,2g
1a + 3b = 0,5
⇒ \(\left\{{}\begin{matrix}a=0,2\\b=0,1\end{matrix}\right.\)
\(m_{MgO}=0,2.40=8\left(g\right)\)
\(m_{Al2O3}=0,1.102=10,2\left(g\right)\)
d) Có : \(n_{MgO}=0,2\left(mol\right)\Rightarrow n_{MgSO4}=0,2\left(mol\right)\)
\(n_{Al2O3}=0,1\left(mol\right)\Rightarrow n_{Al2\left(SO4\right)3}=0,1\left(mol\right)\)
\(m_{MgSO4}=0,2.120=24\left(g\right)\)
\(m_{Al2\left(SO4\right)3}=0,1.342=34,2\left(g\right)\)
\(m_{ddspu}=18,2+250=268,2\left(g\right)\)
\(C_{MgSO4}=\dfrac{24.100}{268,2}=8,95\)0/0
\(C_{Al2\left(SO4\right)3}=\dfrac{34,2.100}{268,2}=12,75\)0/0
e) \(2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O|\)
2 1 1 2
1 0,5
\(n_{NaOH}=\dfrac{0,5.2}{1}=1\left(mol\right)\)
\(m_{NaOH}=1.40=40\left(g\right)\)
\(m_{ddnaOH}=\dfrac{40.100}{12}=333,33\left(g\right)\)
\(V_{ddNaOH}=\dfrac{333,33}{1,1}=303,2\left(ml\right)\)
Chúc bạn học tốt

\(BTNT\left(H\right):n_{H_2SO_4}.2=n_{H_2O}.2\\ \Rightarrow n_{H_2O}=0,6\left(mol\right)\\ BTKL:m_{hh}+m_{H_2SO_4}=m_{muối}+m_{H_2O}\\ \Rightarrow m_{muối}=32+0,6.98-0,6.18=80\left(g\right)\\ \Rightarrow ChọnB\)

a)
\(2Mg + O_2 \xrightarrow{t^o} 2MgO\\ 4Fe + 3O_2 \xrightarrow{t^o} 2Fe_2O_3\\ 2Zn + O_2 \xrightarrow{t^o} 2ZnO\\ 2Cu + O_2 \xrightarrow{t^o} 2CuO\)
b)
Bảo toàn khối lượng :
\(m_{B_1} + m_{O_2} = m_{B_2}\\ \Rightarrow n_{O_2} = \dfrac{10,48-7,6}{32} = 0,09(mol)\)
\(\Rightarrow n_{O(oxit)} = 2n_{O_2} = 0,18(mol)\)
Bản chất của phản ứng là O trong oxit tác dụng với H trong phân tử axit tạo thành nước.
\(2H + O \to H_2O\)
\(n_{H} = 2n_O = 0,36(mol)\)
Bảo toàn nguyên tố với H :
\(n_{H_2SO_4} = \dfrac{n_H}{2} = 0,18(mol)\\ \Rightarrow m_{H_2SO_4} = 0,18.98 = 17,64(gam)\)

Đáp án B.
Các phương trình phản ứng :
Gọi x, y, z lần lượt là số mol của MgO, Fe2O3 và CuO
MgO + H2SO4 → MgSO4 + H2O
Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
CuO + H2SO4 → CuSO4 + H2O
Số mol H2SO4 = 0,3. 2 = 0,6(mol)
1 mol oxit phản ứng tạo thành 1 mol muối ⇒ khối lượng tăng: 96 – 16 = 80g
⇒ mmuối = 32 + 80 . 0,6 = 80g

Tương tự bài 1, ta có:
m 4 o x i t = m m u o i - m H 2 S O 4 + m H 2 O s a n p h a m
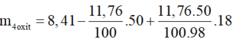
m 4 o x i t = 3,61g
⇒ Chọn C.

Bài 1:
\(n_{H_2SO_4}=\dfrac{300.19,6\%}{98}=0,6\left(mol\right);n_{Al}=\dfrac{2,7}{27}=0,1\left(mol\right)\\ PTHH:2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\\ Vì:\dfrac{0,1}{2}< \dfrac{0,6}{3}\Rightarrow H_2SO_4dư\\ n_{Al_2\left(SO_4\right)_3}=\dfrac{3n_{Al}}{2}=\dfrac{3.0,1}{2}=0,15\left(mol\right)\\ a,m_{Al_2\left(SO_4\right)_3}=342.0,15=51,3\left(g\right)\\ b,m_{ddsau}=m_{Al}+m_{ddH_2SO_4}-m_{H_2}=2,7+300-\dfrac{3}{2}.0,1.2=302,4\left(g\right)\\ c,C\%_{ddAl_2\left(SO_4\right)_3}=\dfrac{51,3}{302,4}.100\%\approx16,964\%\\ n_{H_2SO_4\left(dư\right)}=0,6-\dfrac{3}{2}.0,1=0,45\left(mol\right)\\ C\%_{ddH_2SO_4\left(dư\right)}=\dfrac{0,45.98}{302,4}.100\%\approx14,583\%\)
Bài 2:
\(PTHH:2Al+6HCl\rightarrow2AlCl_3+3H_2\\ Mg+2HCl\rightarrow MgCl_2+H_2\\ Đặt:n_{Al}=a\left(mol\right);n_{Mg}=b\left(mol\right)\left(a,b>0\right)\\ Hpt:\left\{{}\begin{matrix}27a+24b=7,8\\1,5a+b=\dfrac{8,96}{22,4}=0,4\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,2\\b=0,1\end{matrix}\right.\\ \%m_{Al}=\dfrac{0,2.27}{7,8}.100\%\approx69,231\%\Rightarrow\%m_{Mg}\approx100\%-69,231\%\approx30,769\%\)

n O = 39,2.18,367%/16 = 0,45(mol)
Bảo toàn e :
n SO4 2-(trong muối) = n e cho = 2n O + 2n SO2 = 0,45.2 + 0,4.2 = 1,7(mol)
Bảo toàn nguyên tố với S :
n H2SO4 pư = n SO4 2-(trong muối) + n SO2 = 1,7 + 0,4 = 2,1(mol)
=> n H2SO4 đã dùng = 2,1/(100% -20%) = 2,625(mol)
=> a = CM H2SO4 = 2,625/2,5 = 1,05(M)
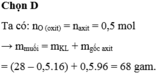
PT: \(MgO+H_2SO_4\rightarrow MgSO_4+H_2O\)
\(Fe_2O_3+3H_2SO_4\rightarrow Fe_2\left(SO_4\right)_3+3H_2O\)
\(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\)
Ta có: \(m_{H_2SO_4}=250.19,6\%=49\left(g\right)\)
\(\Rightarrow n_{H_2SO_4}=\dfrac{49}{98}=0,5\left(mol\right)\)
Theo PT: \(n_{H_2O}=n_{H_2SO_4}=0,5\left(mol\right)\)
Theo ĐL BTKL, có: m oxit + mH2SO4 = m muối + mH2O
⇒ m muối = 24 + 49 - 0,5.18 = 64 (g)
tại sao Fe2O3 + H2SO4 lại không ra là FeSO4 mà lại là Fe2(SO4)3?