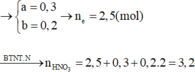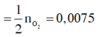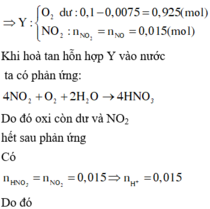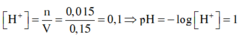Cho 11,2 gam hỗn hợp X gồm Mg và Cu (tỉ lệ mol tương ứng 2:1) tác dụng hết với dung dịch HNO3 2 M dư . Sau khi phản ứng xảy ra hoàn toàn thu được 2,24 lít khí Y gồm NO và N2O có số mol bằng nhau (ở đktc) và dung dịch Z. Tính thể tích dung dịch HNO3 2M đã phản ứng và khối lượng muối khan thu được khi làm bay hơi dung dịch Z ?
K
Khách
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.
Những câu hỏi liên quan

18 tháng 1 2018
Đáp án : D
Vì %V của N2 và NO2 bằng nhau => Qui đổi về NO và N2O
Coi hỗn hợp gồm NO và N2O với tổng số mol = 0,5 và MZ = 35,6g.
Áp dụng qui tắc đường chéo ta có : nNO = 0,3 mol ; nN2O = 0,2 mol
, nHNO3 = 4nNO + 10nN2O = 4.0,3 + 10.0,2 = 3,2 mol

3 tháng 1 2020
Đáp án : A
Y có %VN2 = %VNO2 => qui 2 khí này về NO và N2O => Y có N2O và NO có M = 35,6g và nY = 0,5 mol => nNO = 0,3 ; nN2O = 0,2 mol
,nHNO3 pứ = 4nNO + 10nN2O = 3,2 mol

24 tháng 11 2018
Đáp án C
Ta có nN2O = 0,1 mol; nNO = 0,2 mol và nNO2 = 0,3 mol
Có mmuối = mkl + mNO3- = 100 + 62. ( 0,1. 8 + 0,2. 3+ 0,3) = 205,4 gam
Có nHNO3 pư = 0,1.10 + 0,2. 4 + 0.3.2 = 2,4 mol