Dùng 3,6g khửi Fe2O3 ở nhiệt độ cao. Tính KL Fe tạo ra nếu H=80%
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


gọi x, y lần lượt là số mol của Fe2O3 và CuO
Fe2O3 + 3H2 → 2Fe + 3H2O
x 2x
CuO + H2 → Cu + H2O
y y
ta có phương trình 160x + 80y = 3,6
112x + 64y = 2,64
⇒ x = y = 0,015
⇒ \(m_{Fe_2O_3}=2,4\left(g\right)\); \(m_{CuO}=1,2\left(g\right)\)
Fe + 2HCl → FeCl2 + H2
0,03 0,03
⇒ V = 22,4. 0,03=0,627(l)
Fe2O3 + 3H2 --> 2Fe + 3H2O
x -------> 3x ---> 2x
CuO + H2 --> Cu + H2O
y ------>y ----> y
ta có hệ pt sau
112x + 64y = 2,64 và 160x + 80y = 3,6
<=> x = 0,015 và y = 0,015
=> mFe2O3 = 0,015.160 = 2,4 g => mCuO = 80.0,015 = 1,2 g
nH2 = 3.0,015 + 0,015 = 0,06 mol
=> vH2 = 0,06.22,4 = 1,344 lit

$FeO + H_2 \xrightarrow{t^o} Fe + H_2O$
$n_{H_2} = n_{FeO} = \dfrac{3,6}{72} = 0,05(mol)$
$V_{H_2} = 0,05.22,4 = 1,12(lít)$
\(n_{FeO}=\dfrac{m}{M}=\dfrac{3,6}{72}=0,05\) ( mol )
FeO + H\(_2\) → Fe + H\(_2\)O
0,05 mol → 0,05 mol → 0,05 mol → 0,05 mol
V\(_{H_2}\) = n . 22,4 = 0,05 . 22,4 = 1,12 ( l )

Để giải bài toán này, ta cần biết phương trình phản ứng giữa oxit sắt (Fe2O3) và khí hidro (H2):
Fe2O3 + 3H2 → 2Fe + 3H2O
Theo đó, mỗi mol Fe2O3 cần 3 mol H2 để khử hoàn toàn thành Fe.
a) Thể tích khí hiđro cần dùng:
Ta cần tìm số mol khí hidro cần dùng để khử hoàn toàn 12,8 gam Fe2O3.Khối lượng mol của Fe2O3 là:M(Fe2O3) = 2x56 + 3x16 = 160 (g/mol)
Số mol Fe2O3 là:n(Fe2O3) = m/M = 12.8/160 = 0.08 (mol)
Theo phương trình phản ứng, mỗi mol Fe2O3 cần 3 mol H2 để khử hoàn toàn thành Fe.Vậy số mol H2 cần dùng là:n(H2) = 3*n(Fe2O3) = 0.24 (mol)
Thể tích khí hidro cần dùng ở đktc là:V(H2) = n(H2)22.4 = 0.2422.4 = 5.376 (lít)
Vậy thể tích khí hiđro cần dùng ở đktc là 5.376 lít.
b) Khối lượng Fe thu được sau phản ứng:
Theo phương trình phản ứng, mỗi mol Fe2O3 tạo ra 2 mol Fe.Vậy số mol Fe thu được là:n(Fe) = 2*n(Fe2O3) = 0.16 (mol)
Khối lượng Fe thu được là:m(Fe) = n(Fe)M(Fe) = 0.1656 = 8.96 (gam)
Vậy khối lượng Fe thu được sau phản ứng là 8.96 gam.
c) Thể tích khí hiđro thu được khi Fe tác dụng với HCl:
Ta cần tìm số mol H2 thu được khi Fe tác dụng với HCl.Theo phương trình phản ứng, mỗi mol Fe tác dụng với 2 mol HCl để tạo ra H2 và muối sắt (FeCl2).Số mol HCl cần dùng để tác dụng với Fe là:n(HCl) = m(HCl)/M(HCl) = 14.6/36.5 = 0.4 (mol)
Vậy số mol H2 thu được là:n(H2) = 2n(Fe) = 2(m(Fe)/M(Fe)) = 2*(8.96/56) = 0.16 (mol)
Thể tích khí hiđro thu được ở đktc là:V(H2) = n(H2)22.4 = 0.1622.4 = 3.584 (lít)
Vậy thể tích khí hiđro thu được ở đktc là 3.584 lít.


Bài 1.
1.\(2KMnO_4\rightarrow\left(t^o\right)K_2MnO_4+MnO_2+O_2\)
\(2KClO_3\rightarrow\left(t^o\right)2KCl+3O_2\)
2.\(C+O_2\rightarrow\left(t^o\right)CO_2\)
\(3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\)
\(C_2H_4+5O_2\rightarrow\left(t^o\right)2CO_2+2H_2O\)
\(4FeS_2+11O_2\rightarrow\left(t^o\right)2Fe_2O_3+8SO_2\)
3.\(Fe+H_2SO_4\rightarrow FéO_4+H_2\)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
Cu ko tác dụng với H2SO4 loãng
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
Bài 2.
\(n_{Mg}=\dfrac{m}{M}=0,1mol\)
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
0,1 < 0,3 ( mol )
0,1 0,2 0,1 0,1 ( mol )
\(m_{HCl\left(dư\right)}=\left(0,3-0,2\right).36,5=3,65g\)
\(m_{MgCl_2}=n.M=0,1.95=9,5g\)
\(m_{H_2}=n.M=0,1.2=0,2g\)
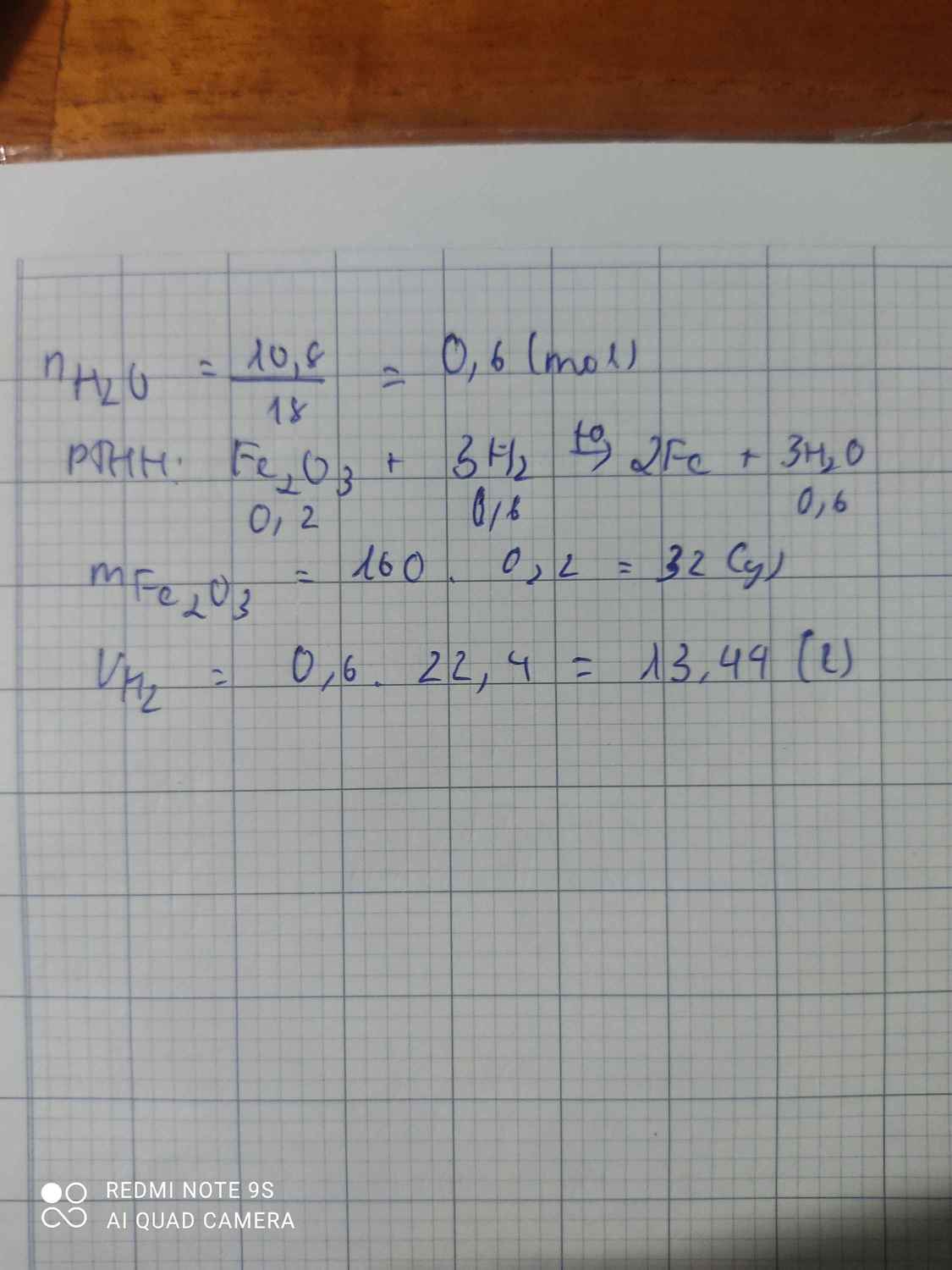
Chất sản phẩm: \(m_{tt}=\dfrac{m_{lt}.H\%}{100\%}\)
Chất tham gia: \(m_{tt}=\dfrac{m_{lt}.100\%}{H\%}\)
\(n_{Fe}=2n_{Fe_2O_3}=2.\dfrac{3,6}{160}=0,045\left(mol\right)\Rightarrow m_{Fe.tạo}=0,045.56=2,52\left(g\right)\\ \Rightarrow m_{Fe.thực.tế}=\dfrac{2,52.80\%}{100\%}=2,016\left(g\right)\)