Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Fe_3O_4}=\dfrac{4,64}{232}=0,02mol\)
\(n_{H_2}=\dfrac{8,96}{22,4}=0,4mol\)
\(Fe_3O_4+4H_2\rightarrow3Fe+4H_2O\)
0,02 0,4 0 0
0,02 0,08 0,06 0,08
0 0,32 0,06 0,08
b)\(m_{Fe}=0,06\cdot56=3,36g\)
\(m_{H_2O}=0,08\cdot18=1,44g\)
c)\(Fe+2HCl\rightarrow FeCl_2+H_2\)
0,06 0,5 0 0
\(\Rightarrow\)Tính theo \(Fe\)
\(\Rightarrow V_{H_2}=0,06\cdot22,4=1,344l\)

a) Fe2O3 + 3H2 --to--> 2Fe + 3H2O
b) \(n_{Fe_2O_3}=\dfrac{16}{160}=0,1\left(mol\right)\)
PTHH: Fe2O3 + 3H2 --to--> 2Fe + 3H2O
0,1--->0,3--------->0,2
=> mFe = 0,2.56 = 11,2 (g)
VH2 = 0,3.22,4 = 6,72 (l)

Để giải bài toán này, ta cần biết phương trình phản ứng giữa oxit sắt (Fe2O3) và khí hidro (H2):
Fe2O3 + 3H2 → 2Fe + 3H2O
Theo đó, mỗi mol Fe2O3 cần 3 mol H2 để khử hoàn toàn thành Fe.
a) Thể tích khí hiđro cần dùng:
Ta cần tìm số mol khí hidro cần dùng để khử hoàn toàn 12,8 gam Fe2O3.Khối lượng mol của Fe2O3 là:M(Fe2O3) = 2x56 + 3x16 = 160 (g/mol)
Số mol Fe2O3 là:n(Fe2O3) = m/M = 12.8/160 = 0.08 (mol)
Theo phương trình phản ứng, mỗi mol Fe2O3 cần 3 mol H2 để khử hoàn toàn thành Fe.Vậy số mol H2 cần dùng là:n(H2) = 3*n(Fe2O3) = 0.24 (mol)
Thể tích khí hidro cần dùng ở đktc là:V(H2) = n(H2)22.4 = 0.2422.4 = 5.376 (lít)
Vậy thể tích khí hiđro cần dùng ở đktc là 5.376 lít.
b) Khối lượng Fe thu được sau phản ứng:
Theo phương trình phản ứng, mỗi mol Fe2O3 tạo ra 2 mol Fe.Vậy số mol Fe thu được là:n(Fe) = 2*n(Fe2O3) = 0.16 (mol)
Khối lượng Fe thu được là:m(Fe) = n(Fe)M(Fe) = 0.1656 = 8.96 (gam)
Vậy khối lượng Fe thu được sau phản ứng là 8.96 gam.
c) Thể tích khí hiđro thu được khi Fe tác dụng với HCl:
Ta cần tìm số mol H2 thu được khi Fe tác dụng với HCl.Theo phương trình phản ứng, mỗi mol Fe tác dụng với 2 mol HCl để tạo ra H2 và muối sắt (FeCl2).Số mol HCl cần dùng để tác dụng với Fe là:n(HCl) = m(HCl)/M(HCl) = 14.6/36.5 = 0.4 (mol)
Vậy số mol H2 thu được là:n(H2) = 2n(Fe) = 2(m(Fe)/M(Fe)) = 2*(8.96/56) = 0.16 (mol)
Thể tích khí hiđro thu được ở đktc là:V(H2) = n(H2)22.4 = 0.1622.4 = 3.584 (lít)
Vậy thể tích khí hiđro thu được ở đktc là 3.584 lít.


nFe2O3 = 16,8/56 = 0,3 (mol)
PTHH: Fe2O3 + 3H2 -> (t°) 2Fe + 3H2O
MOL: 0,15 <--- 0,45 <--- 0,3
VH2 = 0,45 . 22,4 = 10,08 (l)
mFe2O3 = 0,45 . 160 = 72 (g)
a ) Fe2O3 + 3H2 ---> 2Fe + 3H2O
nFe = 16,8 :56 =0,3
Fe2O3 + 3H2--> 2Fe +3H2O
0,15<------0,45<---- 0,3
VH2 = 0,45.22,4=10,08(l)
mFe2O3 = 0,15.160 =24(g)

a) \(n_O=\dfrac{34,8-25,2}{16}=0,6\left(mol\right)\)
=> \(n_{H_2O}=0,6\left(mol\right)\) (bảo toàn O)
=> \(n_{H_2}=0,6\left(mol\right)\) (bảo toàn H)
=> \(V_{H_2}=0,6.22,4=13,44\left(l\right)\)
b) \(n_{Fe}=\dfrac{25,2}{56}=0,45\left(mol\right)\)
nFe : nO = 0,45 : 0,6 = 3 : 4
=> CTHH: Fe3O4
c) \(m_{H_2O}=0,6.18=10,8\left(g\right)\)
Mà \(d_{H_2O}=1\left(g/ml\right)\)
=> \(V_{H_2O}=10,8\left(ml\right)\)

a) \(n_{O_2}=\dfrac{11,2}{22,4}=0,5\left(mol\right)\)
PTHH: 2KMnO4 --to--> K2MnO4 + MnO2 + O2
1<-----------------------------0,5
=> \(m_{KMnO_4}=1.158=158\left(g\right)\)
b) \(n_{Fe_2O_3}=\dfrac{80}{160}=0,5\left(mol\right)\)
PTHH: Fe2O3 + 3H2 --to--> 2Fe + 3H2O
0,5--->1,5
=> \(V_{H_2}=1,5.22,4=33,6\left(l\right)\)
c) \(n_{CuO}=\dfrac{8}{80}=0,1\left(mol\right)\)
\(n_{H_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
PTHH: CuO + H2 --to--> Cu + H2O
Xét tỉ lệ: \(\dfrac{0,1}{1}>\dfrac{0,05}{1}\) => CuO dư, H2 hết
PTHH: CuO + H2 --to--> Cu + H2O
0,05<-0,05---->0,05-->0,05
=> \(n_{Cu\left(dư\right)}=0,1-0,05=0,05\left(mol\right)\)
mCu = 0,05.64 = 3,2 (g)
VH2O = 0,05.22,4 = 1,12 (l)
a)\(n_{O_2}=\dfrac{11,2}{22,4}=0,5mol\)
\(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
1 0,5
\(M_{KMnO_4}=1\cdot158=158g\)
b)\(n_{Fe_2O_3}=\dfrac{80}{160}=0,5mol\)
\(Fe_2O_3+3H_2\rightarrow2Fe+3H_2O\)
0,5 1,5
\(V_{H_2}=1,15\cdot22,4=25,76l\)
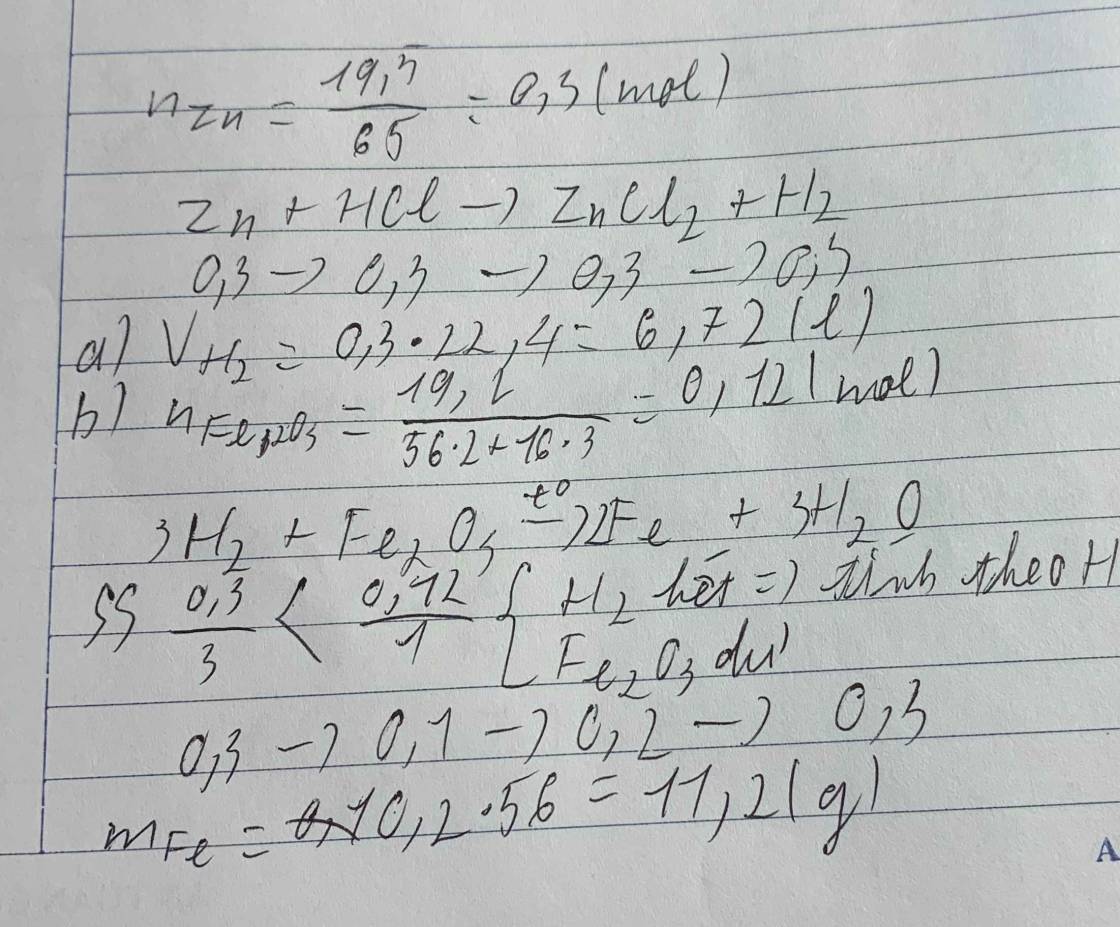

$FeO + H_2 \xrightarrow{t^o} Fe + H_2O$
$n_{H_2} = n_{FeO} = \dfrac{3,6}{72} = 0,05(mol)$
$V_{H_2} = 0,05.22,4 = 1,12(lít)$
\(n_{FeO}=\dfrac{m}{M}=\dfrac{3,6}{72}=0,05\) ( mol )
FeO + H\(_2\) → Fe + H\(_2\)O
0,05 mol → 0,05 mol → 0,05 mol → 0,05 mol
V\(_{H_2}\) = n . 22,4 = 0,05 . 22,4 = 1,12 ( l )