trong phản ứng CuO CÓ bao nhiêu phần trăm oxi
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Ta có: \(n_{CuO}=\dfrac{48}{80}=0,6\left(mol\right)\)
PTHH: \(CuO+CO\xrightarrow[]{t^o}Cu+CO_2\)
BĐ: 0,6 (mol)
Pứ: a_____a_____a____a
Dư: (0,6-a)_________a____a (mol)
Ta có: \(80\cdot\left(0,6-a\right)+64a=43,2\) \(\Rightarrow a=0,3\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{CuO\left(p.ứ\right)}=\dfrac{0,3}{0,6}\cdot100\%=50\%\\m_{Cu}=0,3\cdot64=19,2\left(g\right)\end{matrix}\right.\)

nCuO=2,4/80=0,03(mol)
m(H2SO4)=29,4%.100=29,4(g) -> nH2SO4=29,4/98=0,3(mol)
a) PTHH: CuO + H2SO4 -> CuSO4 + H2O
Ta có: 0,03/1 < 0,3/1
b)=> CuO hết, H2SO4 dư => Tính theo nCuO
nH2SO4(p.ứ)=nCuSO4=nCuO=0,03(mol)
=>nH2SO4(dư)=0,3-0,03=0,27(mol)
=>mH2SO4(dư)=0,27. 98= 26,46(g)
b) mCuSO4=0,03.160= 4,8(g)
mddsau= 2,4+ 100=102,4(g)
C%ddCuSO4= (4,8/102,4).100=4,6875%
C%ddH2SO4(dư)= (26,46/102,4).100= 25,84%
Số mol của đồng (II) oxit
nCuO = \(\dfrac{m_{CuO}}{M_{CuO}}=\dfrac{2,4}{80}=0,03\left(mol\right)\)
Khối lượng của axit sunfuric
C0/0H2SO4 = \(\dfrac{m_{ct}.100}{m_{dd}}\Rightarrow m_{ct}=\dfrac{C.m_{dd}}{100}=\dfrac{29,4.100}{100}=29,4\left(g\right)\)
Số mol của axit sunfuric
nH2SO4 = \(\dfrac{m_{H2SO4}}{M_{H2SO4}}=\dfrac{29,4}{98}=0,3\left(mol\right)\)
a) Pt : CuO + H2SO4 → CuSO4 + H2O\(|\)
1 1 1 1
0,03 0,3 0,03
b) Lập tỉ số so sánh : \(\dfrac{0,03}{1}< \dfrac{0,3}{1}\)
⇒ CuO phản ứng hết , H2SO4 dư
⇒ Tính toán dựa vào số mol của CuO
Số mol dư của axit sunfuric
ndư = nban đầu - nmol
= 0,3 - (0,03 . 1)
= 0,27 (mol)
Khối lượng dư của axit sunfuric
mdư = ndư . MH2SO4
= 0,27 . 98
= 26,46 (g)
c) Số mol của đồng (II) sunfat
nCuSO4 = \(\dfrac{0,03.1}{1}=0,03\left(mol\right)\)
Khối lượng của đồng (II) sunfat
mCuSO4 = nCuSO4 . MCuSO4
= 0,03 . 160
= 4,8 (g)
Khối lượng của dung dịch sau phản ứng
mdung dịch sau phản ứng = mCuO + mH2SO4
= 2,4 + 100
= 102,4 (g)
Nồng độ phần trăm của đồng (II) sunfat
C0/0CuSO4= \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{4,8.100}{102,4}=4,6875\)0/0
Nồng độ phần trăm của axit sunfuric
C0/0H2SO4 = \(\dfrac{m_{ct}.100}{m_{dd}}=\dfrac{26,46.100}{102,4}=25,84\)0/0
Chúc bạn học tốt

Pt : \(CuO+H_2SO_4\rightarrow CuSO_4+H_2O|\)
1 1 1 1
a 1a
\(MgO+H_2SO_4\rightarrow MgSO_4+H_2O|\)
1 1 1 1
b 1b
Gọi a là số mol của CuO
b là số mol của MgO
\(m_{CuO}+m_{MgO}=8\left(g\right)\)
⇒ \(n_{CuO}.M_{CuO}+n_{MgO}.M_{MgO}=8g\)
⇒ 80a + 40b = 8g(1)
Theo phương trình : 1a + 1b = 0,15(2)
Từ(1),(2),ta có hệ phương trình :
80a + 40b = 8g
1a + 1b = 0,15
⇒ \(\left\{{}\begin{matrix}a=0,05\\b=0,1\end{matrix}\right.\)
\(m_{CuO}=0,05.80=4\left(g\right)\)
\(m_{MgO}=0,1.40=4\left(g\right)\)
0/0CuO= \(\dfrac{4.100}{8}=50\)0/0
0/0MgO = \(\dfrac{4.100}{8}=50\)0/0
⇒ Chọn câu : C
Chúc bạn học tốt

a)
$CuO + H_2SO_4 \to CuSO_4 + H_2O$
b)
n CuO = 2,8/80 = 0,035(mol)
n H2SO4 = 140.20%/98 = 2/7 (mol)
Ta thấy :
n CuO / 1 < n H2SO4 /1 nên H2SO4 dư
n H2SO4 pư = n CuO = 0,035(mol)
=> m H2SO4 dư = 140.20% - 0,035.98 = 24,57(gam)
c)
m dd = m CuO + m dd H2SO4 = 2,8 + 140 = 142,8(gam)
C% CuSO4 = 0,035.160/142,8 .100% = 3,92%
C% H2SO4 = 24,57/142,8 .100% = 17,2%

%O = 100% - 68,852% - 4,918% = 26,23%
Gọi công thức của A là C x H y O z
Ta có:
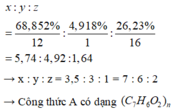
Mặt khác ta có M x < 200 → 122n < 200
→ n = 1
→ X có công thức phân tử là C 7 H 6 O 2 , A có khả năng tham gia phản ứng tráng bạc và phản ứng được với NaOH
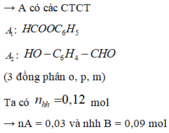
A 1 phản ứng với KOH cho 2 muối HCOOK: 0,03 mol và C 6 H 5 OK : 0,03mol
B phản ứng với KOH cho muối KO - C 6 H 4 - CHO : 0,09 mol
→ m muối = 20,85 gam
Đáp án D
Thành phần phần trăm oxi trong Đồng(II) oxit CuO là:
\(\%mO=\frac{M_O}{M_{CuO}}\cdot100\%=20\%\)