cho 2,24 lít khí CO2 (ĐKTC) vào bình chứa 150ml đ NAOH 1M.Hãy xác định muối tạo thành khối lượng bao nhiêu gam?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Chọn C
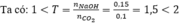
Vậy sau phản ứng thu được 2 muối: NaHCO 3 (x mol) và Na 2 CO 3 (y mol)
Bảo toàn Na có: x + 2y = 0,15 (1)
Bảo toàn C có: x + y = 0,1 (2)
Từ (1) và (2) có x = y = 0,05.
Khối lượng muối có trong Y là m = 0,05 (84 + 106) = 9,5 gam.

$a) CH_4 + 2O_2 \xrightarrow{t^o} CO_2 + 2H_2O$
b) $n_{CH_4} = \dfrac{3,92}{22,4} = 0,175(mol)$
$n_{O_2} = \dfrac{3,84}{32} = 0,12(mol)$
Ta thấy : $n_{CH_4} : 1 > n_{O_2} : 2$ nên $CH_4$ dư
$n_{CH_4\ pư} = \dfrac{1}{2}n_{O_2} = 0,06(mol)$
$\Rightarrow m_{CH_4\ dư} = (0,175 - 0,06).16 = 1,84(gam)$
c) $2NaOH + CO_2 \to Na_2CO_3 + H_2O$
Theo PTHH :
$n_{Na_2CO_3} = n_{CO_2} = \dfrac{1}{2}n_{CH_4} = 0,06(mol)$
$m_{Na_2CO_3} = 0,06.106 = 6,36(gam)$

\(n_{CO_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
\(n_{NaOH}=0,4.0,4=0,16\left(mol\right)\)
Xét tỉ lệ: \(\dfrac{n_{NaOH}}{n_{CO_2}}=\dfrac{0,16}{0,1}=1,6\)
=> Tạo ra muối Na2CO3 và NaHCO3
PTHH: 2NaOH + CO2 --> Na2CO3 + H2O
0,16--->0,08---->0,08
Na2CO3 + CO2 + H2O --> 2NaHCO3
0,02<---0,02------------->0,04
=> \(\left\{{}\begin{matrix}m_{Na_2CO_3}=\left(0,08-0,02\right).106=6,36\left(g\right)\\m_{NaHCO_3}=0,04.84=3,36\left(g\right)\end{matrix}\right.\)
=> mmuối = 6,36 + 3,36 = 9,72 (g)
\(n_{CO_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\\ n_{NaOH}=0,4.0,4=0,16\left(mol\right)\)
\(T=\dfrac{0,16}{0,1}=1,6\rightarrow\) Tạo cả 2 muối
Gọi \(\left\{{}\begin{matrix}n_{Na_2CO_3}=a\left(mol\right)\\n_{NaHCO_3}=b\left(mol\right)\end{matrix}\right.\)
PTHH: 2NaOH + CO2 ---> Na2CO3 + H2O
2a a a
NaOH + CO2 ---> NaHCO3
b b b
Hệ pt: \(\left\{{}\begin{matrix}2a+b=0,16\\a+b=0,1\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,06\left(mol\right)\\b=0,04\left(mol\right)\end{matrix}\right.\)
=> mmuối = 0,06.106 + 0,04.84 = 9,72 (g)

Đáp án A
nCO2 = 0,1 mol; nNaOH = 0,2 mol.
n O H n C O 2 = 2 ⇒ CO2 phản ứng vừa đủ với NaOH và tạo muối Na2CO3:
CO2 + 2NaOH → Na2CO3 + H2O.
nNa2CO3 = nCO2 = 0,1 mol ⇒ mNa2CO3 = 10,6 gam.

Theo đề bài ta có : \(\left\{{}\begin{matrix}nCO2=\dfrac{2,24}{22,4}=0,1\left(mol\right)\\nNaOH=0,15.1=0,15\left(mol\right)\end{matrix}\right.\)
Ta xét tỉ lệ :
T = \(\dfrac{nNaOH}{nCO2}=\dfrac{0,15}{0,1}=1,5< 2\)
Vì 1 < T < 2 nên => sau p/ư thu được 2 muối
Gọi x ,y lần lượt là số mol của CO2 tham gia vào 2 PT tạo muối
Ta có PTHH :
\(\left(1\right)CO2+2NaOH->Na2CO3+H2O\)
x mol...........2xmol..............x mol
\(\left(2\right)CO2+NaOH->NaHCo3\)
y mol...........y mol............ y mol
Ta có HPT : \(\left\{{}\begin{matrix}x+y=0,1\\2x+y=0,15\end{matrix}\right.=>\left\{{}\begin{matrix}x=0,05\\y=0,05\end{matrix}\right.=>\left\{{}\begin{matrix}nNa2CO3=0,05\left(mol\right)\\nNaHCo3=0,05\left(mol\right)\end{matrix}\right.\) => \(\left\{{}\begin{matrix}mNa2CO3=106.0,05=5,3\left(g\right)\\mNaHCo3=84.0,05=4,2\left(g\right)\end{matrix}\right.\)
2NaOH + CO2 \(\rightarrow\)Na2CO3 + H2O
nCO2=\(\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
nNaOH=0,15.1=0,15(mol)
Vì 0,1.2>0,15 nên NaOH hết
Theo PTHH ta có:
\(\dfrac{1}{2}\)nNaOH=nNa2CO3=0,075(mol)
mNa2CO3=0,075.106=7,95(mol)

nSO2=2,24/22.4=0,1 mol
a)
nNaOH=0,5*1=0,5mol
Đặt T=nNaOH/nSO2=0,5/0,1=5
Vì T> 2--->PT tạo muối trung hoà Na2SO3( NaOH dư)
PTHH: SO2 + 2NaOH----> Na2SO3 + H2O
----->nNa2SO3=nSO2=0,1 mol
------>mNa2SO3=0.1*126=12,6g
b)
nNaOH=0.15*1=0.15 mol
Đặt T=nNaOH/ nSO2=0,15/0,1=1,5
Vì 1<T<2----> P/Ứ tạo 2 muối là Na2cO3 và NaHO3
PTHH
SO2 + 2NaOH------> Na2CO3 + H2O
a--------- 2a --------- a
SO2 + NaOH-----> NaHCO3
b b b
Gọi số mol của N2SO3 và NaHSO3 lần lượt là a và b
Ta có: \(\begin{cases}a+b=0,1\\2a+b=0,15\end{cases}\)
-\(\Rightarrow\) a=0,05 mol ; b=0,05 mol
----->m Na2SO3= 0,05*126=6.3g
mNaHSO3=0,05*72=3,6g
![]() không biết đúng không nữa!!!
không biết đúng không nữa!!!

9
nSO2 = 4,48 : 22,4 = 0,2 (mol) ; nNaOH = 16: 40 = 0,4 (mol)
Ta thấy nNaOH/ nSO2 = 2 => chỉ tạo muối Na2SO3
=> mNa2SO3 = 0,2. 126 = 25, 2(g) =>D
10
nBa(OH) = 0,15.1 = 0,15mol; nBaCO3 = 19,7 : 197 = 0,1mol
Vì nBaCO3 < nBa(OH)2 → xét 2 trường hợp
Trường hợp 1: Ba(OH)2 dư, CO2 hết, phản ứng chỉ tạo muối cacbonat
CO2 + Ba(OH)2 → BaCO3 + H2O
0,1 0,1
Vậy V = VCO2 = 0,1.22,4 =2,24
Trường hợp 2: Phản ứng sinh ra 2 muối cacbonat và hiđrocacbonat
CO2 + Ba(OH)2→ BaCO3 + H2O (1)
0,1 0,1 0,1
2CO2+Ba(OH)2→Ba(HCO3)2
0,1 0,05
Theo phương trình (1): nBa(OH)2(1) = nBaCO3=0,1mol
Mà nBa(OH)2= 0,15mol →nBa(OH)2 (2) = 0,15−0,1 = 0,05mol
Theo (1) và (2): nCO2 = nBaCO3 + 2nBa(OH)2 (2) = 0,1 + 2.0,05 = 0,2 mol
Vậy V = VCO2 = 0,2.22,4 = 4,48 lít
=>A

\(a) n_{SO_2} = \dfrac{3,36}{22,4} = 0,15(mol) ; n_{NaOH} = 0,15.2 = 0,3(mol)\\ \dfrac{n_{NaOH}}{n_{SO_2}} = \dfrac{0,3}{0,15} = 2\)
Suy ra muối tạo thành là Na2SO3
\(b) n_{SO_2}= \dfrac{6,4}{32} = 0,2(mol) ; n_{NaOH} = 0,05.1 = 0,05(mol)\\ \dfrac{n_{NaOH}}{n_{SO_2}} = \dfrac{0,05}{0,2} = 0,25 <1\)
Suy ra muối tạo thành là NaHSO3
\(c) n_{SO_2} = \dfrac{4,48}{22,4} = 0,2(mol) ; n_{NaOH} = 0,1(mol)\\ \dfrac{n_{NaOH}}{n_{SO_2} }=\dfrac{0,1}{0,2} = 0,5 <1\)
Suy ra muối tạo thành là Na2SO3
a) Ta có: \(\left\{{}\begin{matrix}n_{SO_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\\n_{NaOH}=2\cdot0,15=0,3\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\) Tạo muối trung hòa
PTHH: \(2NaOH+SO_2\rightarrow Na_2SO_3+H_2O\)
Các phần còn lại thì tương tự, bạn dựa vào hình dưới để làm nhé !
*P/s: Thay CO2 bằng SO2
mọi người cố gắng giúp mình giải bài này với
Phương trình : 2NaOH + CO2 -----> Na2CO3 + H2O
Có : \(n_{CO_2}=\frac{2,24}{22,4}=\frac{1}{10}=0,1\left(mol\right)\)
\(n_{NaOH}=\frac{150}{1000}.1=0,15\left(mol\right)\)
Theo phương trình , có :
\(n_{NaOH}=2.0,1=0,2\left(mol\right)\) (tính theo nCO2)
Mà \(0,2>0,15\) (mol)
=> \(NaOH\) phản ứng hết .
Vậy ta lấy \(n_{NaOH}\) từ phương trình để tính
Theo phương trình :
\(\frac{1}{2}.n_{NaOH}=n_{Na_2CO_3}=0,075\left(mol\right)\)
=> \(m_{Na_2CO_3}=0,075.M=0,075.106=7,95\left(g\right)\)
P/s : bữa sau có môn nào ngoài toán thì đừng đăng bên đây :v , nếu không thì bị ăn gạch :)