Viết phương trình hoá học khi cho dung dịch H2SO4 đặc tác dụng với KBr, C. Cho biết sản phẩm khử duy nhất là SO2.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án A
Bảo toàn e : 2nCu = 2nSO2 = 2.0,15
=> mCu = 9,6g
=>A

2 Fe + 2n H2SO4 --> Fe2(SO4)n + n SO2 + n H2O
a------------an-----------0,5a
số mol Fe bằng 37,5% => a = 0,375*na => n = 2,667 khối lượng muối = 0,5a(56+96n) = 8,28 => a = 0,045 khối lượng Fe = 56*0,045 = 2,52
=> Đáp án A

Thí nghiệm 1 :
\(n_{Mg} = a(mol) ; n_{Fe} = b(mol) \\ \Rightarrow 24a + 56b = 15,6(1)\\ Mg + H_2SO_4 \to MgSO_4 + H_2\\ Fe + H_2SO_4 \to FeSO_4 + H_2\\ n_{H_2} =a + b = 0,3(2)\\ (1)(2) \Rightarrow a = 0,0375 ; b = 0,2625\)
Thí nghiệm 2 : Vì khối lượng thí nghiệm 1 bằng 3 lần khối lượng thí nghiệm 2 nên ở thì nghiệm 2 : \(n_{Mg} = \dfrac{0,0375}{3}=0,0125(mol)\\ n_{Fe} = \dfrac{0,2625}{3} = 0,0875(mol)\\ \text{Bảo toàn electron : }\\ n_{SO_2} = \dfrac{0,0125.2 + 0,0875.3}{2} = 0,14375(mol)\\ m_X - m_{SO_2} = 5,2 - 0,14375.64 = -4\)
Vậy khối lượng dung dịch Z giảm 4 gam so với H2SO4 ban đầu.

Đáp án D
Hỗn hợp phản ứng với H2SO4 loãng dư chỉ có Fe phản ứng (vì Cu đứng sau H)
Hỗn hợp phản ứng với H2SO4 đặc nguội dư thì chỉ có Cu phản ứng (Fe bị thụ động)
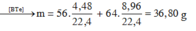

Đáp án D
Có 
=> ![]()
gam gần nhất với giá trị 36,82
=> Chọn đáp án D.

Đáp án D.
Có n F e = n H 2 = 4 , 48 22 , 4 = 0 , 2 m o l n C u = n S O 2 = 8 , 96 22 , 4 = 0 , 4 m o l ⇒ m = 56 . 0 , 2 + 64 . 0 , 4 = 36 , 8 g a m
gần nhất với giá trị 36,82
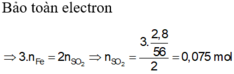

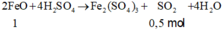
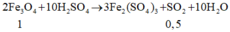
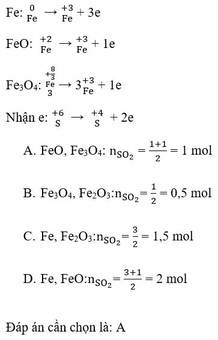
\(2H_2SO_{4,đặc}+2KBr\rightarrow K_2SO_4+Br_2+SO_2+2H_2O\)