Hỗn hợp X gồm: 0,1 mol Cu; 0,2 mol Al và 0,3 mol Mg.
a) Tính % khối lượng mỗi kim loại trong hỗn hợp X.
b) Tính số gam acid HCl cần dùng để phản ứng vừa hết với hỗn hợp X. Từ đó tính thể tích khi thoát ra (đo ở đkc).
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Gọi nNO, NO2 lần lượt là 2x và 3x
Bảo toàn ne=> nAg + 2nCu = 3nNO + nNO2=> 0,1 + 2.0,04 = 3.2x + 3x => x = 0,02
=> VX = 5x.22,4 = 2,24 lít => Chọn B.

a, \(\overline{M}=\dfrac{0,1.44+0,2.28}{0,1+0,2}\approx33,33\left(g/mol\right)\)
b, \(\overline{M}=\dfrac{0,2.28+0,3.2}{0,2+0,3}=12,4\left(g/mol\right)\)
c, \(\overline{M}=\dfrac{0,1.28+0,2.30+0,2.44}{0,1+0,2+0,2}=35,2\left(g/mol\right)\)
d, \(\overline{M}=\dfrac{0,2.56+0,1.24+0,1.27}{0,2+0,1+0,1}=40,75\left(g/mol\right)\)

Đáp án C:
AgNO3 và Cu(NO3) phản ứng hết
=> Fe còn dư hoặc phản ứng vừa đủ.
![]()
=> nFe phản ứng = 0,03 (mol) nFe dư = 0,07 (mol)
=> mCu + mAg =20 - 0,07.56 = 16,08 (g)
Đặt xvà y lần lượt là số mol của Ag và Cu
=> 108x+64y = 16,08
Bảo toàn electron ta có: ne cho = ne nhận
=> 2nMg + 2nFe phản ứng = nAg + 2nCu =>x + 2y = 0,36


Chọn đáp án A
(1) 0,lmol Fe và 0,1 mol Fe3O4; Có F e + 2 F e 3 + → 3 F e 2 +
(2) 0,lmol FeS và 0,1 mol CuS; Không vì CuS không tan trong axit loãng
(3) 0,1 mol Cu và 0,1 mol Fe3O4; Có C u + F e 3 + → 2 F e 2 + + C u 2 +
(4) 0,02 mol Cu và 0,5 mol Fe(NO3)2; Có
(5) 0,1 mol MgCO3 và 0,1 mol FeCO3. Có

\(Ag_2O+2HNO_3\rightarrow2AgNO_3+H_2O\)
..0,1.................................0,2....................
\(3Cu+8HNO_3\rightarrow3Cu\left(NO_3\right)_2+2NO+4H_2O\)
.0,2................................0,2.......................................
Ta có : \(a=m_{Ag\left(NO\right)_3}+m_{Cu\left(NO_3\right)_2}=0,2.188+0,2.170=71,6\left(g\right)\)

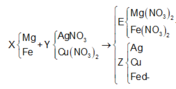
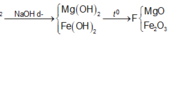
Trong F có 0,15 mol MgO và x mol Fe2O3 nên
0,1540 +x.160 = 8,4 ⇔ x = 0,015
nFe phản ứng = = 0,03
nFe dư = 0,1 – 0,03 = 0,07.
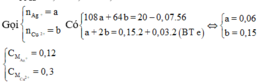
Đáp án C
a) \(m_X=0,1\cdot64+0,2\cdot27+0,3\cdot24=19\left(g\right)\)
\(\Rightarrow\%m_{Cu}=\dfrac{0,1\cdot64\cdot100}{19}=34\%\)
\(\Rightarrow\%m_{Al}=\dfrac{0,2\cdot27\cdot100}{19}=28\%\)
\(\Rightarrow\%m_{Mg}=100\%-34\%-28\%=38\%\)
b) \(Cu+2HCl\rightarrow CuCl_2+H_2\) (1)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\) (2)
\(Mg+2HCl\rightarrow MgCl_2+H_2\) (3)
\(n_{HCl\left(1\right)}=2n_{Cu}=2\cdot0,1=0,2\left(mol\right)\)
\(n_{HCl\left(2\right)}=\dfrac{6\cdot n_{Al}}{2}=3\cdot0,2=0,6\left(mol\right)\)
\(n_{HCl\left(3\right)}=2n_{Mg}=2\cdot0,3=0,6\left(mol\right)\)
\(\Rightarrow m_{HCl}=\left(0,2+0,6+0,6\right)\cdot36,5=51,1\left(g\right)\)
\(n_{H_2\left(1\right)}=n_{Cu}=0,1\left(mol\right);n_{H_2\left(2\right)}=\dfrac{3\cdot0,2}{2}=0,3\left(mol\right);n_{H_2\left(3\right)}=n_{Mg}=0,3\left(mol\right)\)
\(V_{H_2\left(dkc\right)}=\left(0,1+0,3+0,3\right)\cdot24,79=17,353\left(l\right)\)
Cu ko td với HCl nhé