Calcium và fluorine kết hợp thành phân tử calcium fluorine, CaF2. Trong đó, nguyên tử nào đã nhường và nhường bao nhiêu electron? Nguyên tử nào đã nhận và nhận bao nhiêu electron?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


- Cấu hình electron B (Z = 5): 1s22s22p1 => Có 3 electron ở lớp ngoài cùng => Xu hướng nhường đi 3 electron
- Cấu hình electron K (Z = 19): 1s22s22p63s23p64s1 => Có 1 electron ở lớp ngoài cùng => Xu hướng nhường đi 1 electron
- Cấu hình electron He (Z = 2): 1s2 => Đạt cấu hình bền vững
- Cấu hình electron F (Z = 9): 1s22s22p5 => Có 7 electron ở lớp ngoài cùng => Xu hướng nhận thêm 1 electron
=> Nguyên tử nguyên tố Potassium (K, Z = 19) có xu hướng nhường đi 1 electron khi hình thành liên kết hóa học
Đáp án B

- Cấu hình nguyên tử nitrogen (Z = 7): 1s22s22p3
=> Có 5 electron ở lớp vỏ ngoài cùng => Có xu hướng nhận thêm 3 electron để đạt cấu hình electron khí hiếm
- Cấu hình nguyên tử nhôm (Z = 13): 1s22s22p63s23p1
=> Có 3 electron ở lớp vỏ ngoài cùng => Có xu hướng nhường đi 3 electron để đạt cấu hình electron khí hiếm
Đáp án A

Chọn đáp án A
Các nguyên tử nguyên tố halogen có 7 electron ở lớp ngoài cùng. Để đạt cấu hình electron bền vững của khí hiếm, chúng dễ nhận thêm 1e để tạo thành anion.

Để chuyển thành anion mang điện tích âm, nguyên tử của các nguyên tố nhóm halogen nhận thêm electron (do có 7 e lớp ngoài cùng).

Liti mất 1e (3 – 1 = 2) lớp ngoài cùng nên ion Li mang điện tích +1
Nito thêm 3e (5 + 3 = 8) lớp ngoài cùng nên ion N mang điện tích –5 (N–5)
Công thức phân tử Li3N

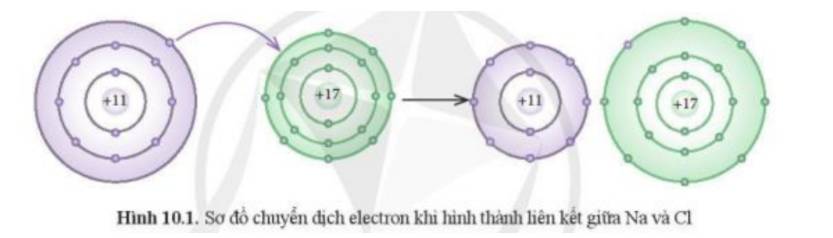
- Theo Hình 10.1 ta thấy:
+ Kim loại Na có 1 electron ở lớp vỏ ngoài cùng => Xu hướng nhường đi 1 electron để đạt cấu hình khí hiếm
+ Phi kim Cl có 7 electron ở lớp vỏ ngoài cùng => Xu hướng nhận thêm 1 electron để đạt cấu hình khí hiếm
=> Cl đã nhận thêm 1 electron từ Na để trở thành các ion
=> Phát biểu (1) phù hợp với sơ đồ phản ứng ở Hình 10.1

- Cấu hình electron của F (Z = 9): 1s22s22p5
- Đề xuất của bạn học sinh không hợp lí trong thực tế vì:
+ Fluorine là nguyên tử có độ âm điện lớn nên khả năng nhận 1 electron dễ hơn nhường 7 electron.
+ Hai nlguyên tử F có độ âm điện bằng nhau nên không hình thành được liên kết ion như công thức (F7+)(F-)7 mà chỉ tạo được liên kết cộng hóa trị không cực.
- Sự hình thành liên kết trong phân tử F2:
Để đạt cấu hình của khí hiếm gần nhất, mỗi nguyên tử F đều cần thêm 1 electron. Vì vậy mỗi nguyên tử N cùng góp 1 electron để tạo nên 1 cặp electron chung cho 2 nguyên tử N.

⟹ Hai nguyên tử F liên kết với nhau bằng liên kết cộng hóa trị không cực tạo phân tử F2:
F - F

- Ta có: O và F đều là phi kim => Xu hướng cơ bản của nguyên tử O và F trong phản ứng hóa học là nhận electron
- Cấu hình electron O (Z = 8): 1s22s22p4 => Có 6 electron ở lớp vỏ ngoài cùng => Xu hướng nhận 2 electron
- Cấu hình electron F (Z = 9): 1s22s22p5=> Có 7 electron ở lớp vỏ ngoài cùng => Xu hướng nhận 1 electron

- Nguyên tử Fluorine có 7 electron ở lớp ngoài cùng => Nhận 1 electron từ nguyên tử Calcium để đạt cấu hình electron của khí hiếm
- Nguyên tử Calcium có 2 electron ở lớp ngoài cùng => Nhường 2 electron cho 2 nguyên tử Fluorine để đạt cấu hình electron của khí hiếm