Khi cho kim loại 6,5 kim loại Zn phản ứng với axit sunfuric loãng tính khối lượng muối znso4 thu được sau phản ứng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\)
PTHH:
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
0,1 0,1 0,1 0,1
\(m_{H_2SO_4}=0,1.98=9,8\left(g\right)\)
\(m_{ZnSO_4}=0,1.161=16,1\left(g\right)\)
\(V_{H_2}=0,1.24,79=2,479\left(l\right)\)

\(a.Zn+2HCl\rightarrow ZnCl_2+H_2\\ b.n_{Zn}=n_{ZnCl_2}=0,1\left(mol\right)\\ \Rightarrow m_{ZnCl_2}=0,1.136=13,6\left(g\right)\\ c.n_{H_2}=n_{Zn}=0,1\left(mol\right)\\ \Rightarrow V_{H_2}=0,1.22,4=2,24\left(l\right)\)

a) Zn + 2HCl → ZnCl2 + H2
b) mZnCl2 = 0,1 . 136 = 13,6 gam
c) nZn = 6,5/65 = 0,1 mol . Theo tỉ lệ pư => nH2 = nZn = nZnCl2 =0,1 mol <=> VH2(đktc) = 0,1.22,4 = 2,24 lít.

a, \(n_{H_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
PTHH: Cu + H2SO4 l → ko phản ứng
PTHH: Fe + H2SO4 → FeSO4 + H2
Mol: 0,05 0,05 0,05
\(m_{Fe}=0,05.56=2,8\left(g\right)\Rightarrow m_{Cu}=3,44-2,8=0,64\left(g\right)\)
b, \(m_{H_2SO_4}=0,05.98=4,9\left(g\right)\)

Gọi x,y lần lượt là số mol của Al, Fe
nH2 = \(\dfrac{8,96}{22,4}\)=0,4 mol
Pt: 2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
......x.................................0,5x...........1,5x
.....Fe + H2SO4 --> FeSO4 + H2
.......y..........................y............y
Ta có hệ pt:
{27x+56y=11
1,5x+y=0,4
⇔x=0,2, y=0,1
% mAl = \(\dfrac{0,2.27}{11}\).100%=49,1%
% mFe = \(\dfrac{0,1.56}{11}\).100%=50,9%
mAl2(SO4)3 = 0,5x . 342 = 0,5 . 0,2 . 342 = 34,2 (g)
mFeSO4 = 152y = 152 . 0,1 = 15,2 (g)
Gọi CTTQ: MxOy
Pt: MxOy + yH2 --to--> xM + yH2O
\(\dfrac{0,4}{y}\)<-------0,4
Ta có: 232,2=\(\dfrac{0,4}{y}\)(56x+16y)
⇔23,2=\(\dfrac{22,4x}{y}\)+6,4
⇔\(\dfrac{22,4x}{y}\)=16,8
⇔22,4x=16,8y
⇔x:y=3:4
Vậy CTHH của oxit: Fe3O4

\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\uparrow\\ n_{H_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\\ n_{Zn}=n_{H_2SO_4}=n_{H_2}=0,05\left(mol\right)\\ m_{Zn}=0,05.65=3,25\left(g\right)\\ m_{\text{dd}H_2SO_4}=\dfrac{0,05.98}{19,6\%}=25\left(g\right)\\ V_{\text{dd}H_2SO_4}=\dfrac{25}{1,84}\approx13,587\left(ml\right)\)

a) Phương trình phản ứng:
Zn + H2SO4 → ZnSO4 + H2
Fe + H2SO4loãng → FeSO4 + H2
2Al+ 3H2SO4 → Al2(SO4)3 + 3H2
b) Giả sử cho cùng một khối lượng là a g kim loại kẽm sắt và nhôm
Zn + H2SO4 → ZnSO4 + H2 (1)
Fe + H2SO4loãng → FeSO4 + H2 (2)
2Al+ 3H2SO4 → Al2(SO4)3 + 3H2 (3)
Ta có 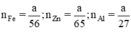
Theo pt nH2 (1) = nZn = 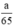 mol
mol
nH2 (2) = nFe = 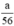 mol
mol
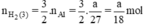
Như vậy ta nhận thấy 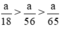 ⇒ nH2 (3) > nH2 (2) > nH2 (1)
⇒ nH2 (3) > nH2 (2) > nH2 (1)
Như vậy cho cùng một lượng kim loại tác dụng với axit H2SO4 loãng dư thì nhôm cho nhiều khí hidro hơn, sau đó đến sắt và ít nhất là kẽm
c) Nếu thu được cùng một lượng khí hidro thì khối lượng kim loại ít nhất là nhôm, sau đó đến sắt, cuối cùng là kẽm.

Chỉ có Zn phản ứng thôi. Cu không phản ứng, không tan.---->Chất rắn không tan là Cu
Zn+ H2SO4 ---> ZnSO4+ H2↑
0.1 0.1
nH2= 2.24: 22.4=0.1 mol
mZn= 0.1x65=6.5 g
mCu=10.5-6,5=4 g
%Zn=6.5:10.5x100%=61.9%
%Cu=4:10.5x100%=38.1%

Pt:\(Cu+H_2SO_4\xrightarrow[]{X}\)
\(Mg+H_2SO_4\rightarrow MgSO_4+H_2\)(1)
a) nH2 = \(\dfrac{3,36}{22,4}=0,15mol\)
Theo pt (1) nMg = nH2 = 0,15 mol
=> mMg = 0,15.24 = 3,6g
=> m Cu = 5,2 - 3,6 = 1,6g
b) Theo pt (1) nMgSO4 = nH2 = 0,15 mol
=> mMgSO4 = 0,15.120 = 18g
\(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\)
PTHH :
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\uparrow\)
0,1 0,1
\(m_{ZnSO_4}=0,1.161=16,1\left(g\right)\)
\(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\)
PTHH : \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
\(n_{Zn}=n_{ZnSO4}=0,1\left(mol\right)\Rightarrow m_{ZnSO4}=0,1.161=16,1\left(g\right)\)