Cho 10g CaO vào 100g đe HCl 36,5% a) tính khối lượng muối tạo thành sau p.ứng b) tính C% đe sau p.ứng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Bài 9:
\(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\\ n_{HCl}=\dfrac{14,6\%.100}{36,5}=0,4\left(mol\right)\\ PTHH:Zn+2HCl\rightarrow ZnCl_2+H_2\\ Vì:\dfrac{0,1}{1}< \dfrac{0,4}{2}\Rightarrow HCldư\\ n_{HCl\left(dư\right)}=0,4-2.0,1=0,2\left(mol\right)\\ m_{HCl\left(dư\right)}=0,2.36,5=7,3\left(g\right)\)

1. Câu 1: nP = 0.2 mol , nO2= 0.3 mol
PTPU: 4P + 5O2 --> 2P2O5
a) Theo phản ứng: nếu dùng hết 0.2 mol P cần số mol O2 tương ứng là (0.2*5)/4 = 0.25 mol <0.3 mol.
Suy ra O2 dư. Số mol O2 dư là 0.05 mol, hay khối lượng O2 dư là 0.8 gam
b) Chất được tạo thành P2O5, mP2O5 = 0.01*142= 1.42 gam
2. Câu 2: CaCO3 --> CaO + CO2
Theo lý thuyết: Từ 150 kg CaCO3 sẽ tạo ra khối lượng CaO theo phương trình tương ứng là mCaO lt = (150*56)/100 = 84 kg.
Theo thực tế thu được khối lượng CaO là mCaO tt = 67.2 kg.
Suy ra Hiệu suất H = (mCaO tt *100)/ mCaO lt = 80%
Chúc bạn học tốt ![]()

a/ PTHH: 4P + 5 O\(_2\) ----> 2P\(_2\)O\(_5\)
nP = 6,2/31 = 0,2 mol
nO\(_2\)= 6,72 : 22,4 =0,433 mol
=> Ôxi dư
nO\(_2\)dư = 0,433-(0,2 : 4 . 5) = 0,183 mol
=> mO\(_2\)dư = 0,183 . 16 = 2,928g
b/ Chất được tạo thành là P\(_2\)O\(_5\)
Ta có: mP2O5 = 0,05. (31.2+16.4)=7,1g

a) \(n_{NaOH}=0,1.2=0,2\left(mol\right);n_{HCl}=0,15.1=0,15\left(mol\right)\)
PTHH: NaOH + HCl → NaCl + H2O
Mol: 0,15 0,15 0,15
Ta có: \(\dfrac{0,2}{1}>\dfrac{0,15}{1}\) ⇒ NaOH dư, HCl hết
b, \(m_{NaCl}=0,15.58,5=8,775\left(g\right)\)
c, tự làm

Mình có một số câu hỏi :
Các số liệu trên đc đo ở điều kiện nào ? Câu a, tính khối lượng các chất tức là tính cả khối lượng của HCl thì cần gì làm câu b, nữa ???
Nếu các số liệu đc đo ở đktc thì đây
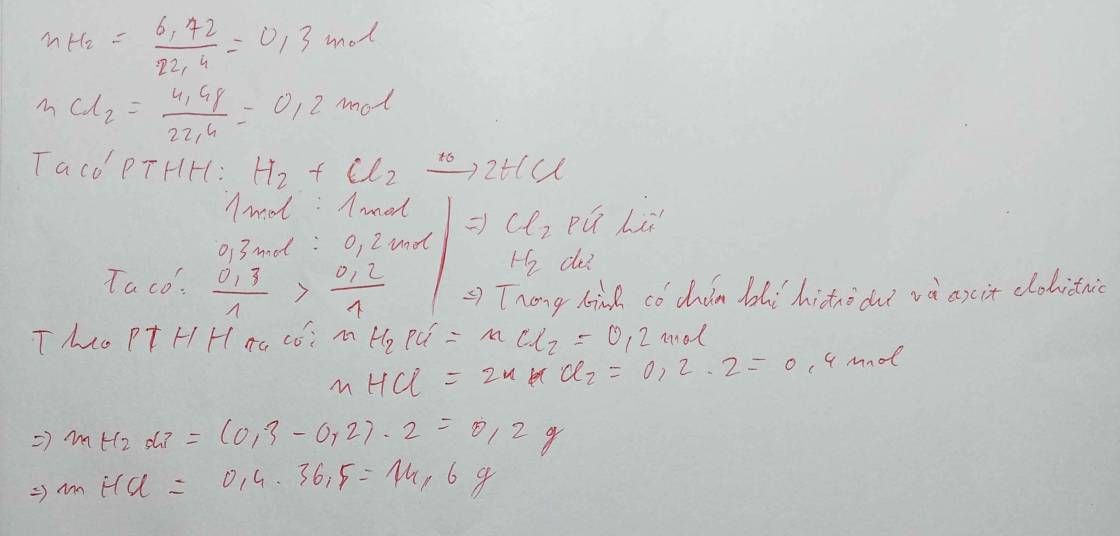
![]()
![]()

nNa2CO3=0,05.0,2=0,01
nCaCl2=0,1.0,15=0,015
a. Na2CO3 + CaCl2 --> 2NaCl + CaCO3
0,01 --> 0,01-->0,02
CM(NaCl)=0,02/(0,05+0,1)=0,13M
CM(CaCl2 còn lại) = (0,015-0,01)/(0,05+0,1)=0,003M
b, tính gì vậy bạn?

a,\(n_{CO_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
PTHH: CaCO3 + 2HCl → CaCl2 + CO2 + H2O
Mol: 0,1 0,2 0,1
\(m_{CaCO_3}=0,1.100=10\left(g\right)\)
b,\(C\%_{ddHCl}=\dfrac{0,2.36,5.100\%}{150}=4,87\%\)
c,mdd sau pứ= 10+150-0,1.44 = 151,2 (g)
\(C\%_{ddCaCl_2}=\dfrac{0,1.111.100\%}{151,2}=7,34\%\)

a,\(n_{H_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
PTHH: Mg + 2HCl → MgCl2 + H2
Mol: 0,05 0,1 0,05 0,05
PTHH: MgO + 2HCl → MgCl2 + H2O
Mol: 0,1 0,2 0,1
⇒ mMg = 0,05.24 = 1,2 (g)
mMgO = 5,2 - 1,2 = 4 (g)
b,\(n_{MgO}=\dfrac{4}{40}=0,1\left(mol\right)\)
⇒ nHCl đã dùng = 0,1+0,2 = 0,3 (mol)
\(C_{M_{ddHCl}}=\dfrac{0,3}{0,5}=0,6\left(l\right)\)
c,\(C_{M_{MgCl_2}}=\dfrac{0,05+0,1}{0,6}=0,25M\)
\(a)n_{CaO}=\dfrac{10}{56}=\dfrac{5}{28}mol\\ n_{HCl}=\dfrac{100.36,5}{100.36,5}=1mol\\ CaO+2HCl\rightarrow CaCl_2+H_2O\\ \Rightarrow\dfrac{5:28}{1}< \dfrac{1}{2}\Rightarrow HCl.dư\\ CaO+2HCl\rightarrow CaCl_2+H_2O\\ \dfrac{5}{28}.....\dfrac{5}{14}......\dfrac{5}{28}.......\dfrac{5}{28}\)
\(m_{CaCl_2}=\dfrac{5}{28}\cdot111\approx19,82g\\ b)C_{\%CaCl_2}=\dfrac{19,82}{100+10}=18,02\%\\ C_{\%HCl}=\dfrac{\left(0,1-5:14\right)36,5}{100+10}\cdot100=21,33\%\)