Giải thích hiện tượng xảy ra trong hai ống nghiệm ở Thí nghiệm 1.


Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Hiện tượng:
Ống nghiệm 1: Chất rắn tan hết tạo thành dung dịch màu tím.
Ống nghiệm 2: Tàn đóm đỏ bùng cháy. Hòa vào nước chất rắn còn lại một phần không tan hết.
Giải thích:
Ống 1: Thuộc hiện tượng vật lí vì không có sự biến đổi về chất.
Ống 2: Thuộc hiện tượng hóa học vì có chất mới sinh ra (khí oxi làm cho tàn đóm bùng cháy, chất không tan hết là manganđioxit).

Ở ống (1) có phản ứng:
CH3-CH2-Br + H2O  CH3-CH2-OH + HBr
CH3-CH2-OH + HBr
AgNO3 + HBr → AgBr ↓ + HNO3
Vàng nhạt
Ống (2):
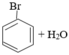 → không có phản ứng không có hiện tượng gì
→ không có phản ứng không có hiện tượng gì
Nhận xét: Liên kết C-Br mạch hở (trong CH3-CH2-Br) kém bên hơn liên kết của Br trực tiếp với C ở vòng benzen.

Nếu bỏ ngón tay bịt đầu ống ra thì phần không khí phía trên cột nước trong ống thông với khí quyển, áp suất khí trong ống cộng với áp suất cột nước sẽ lớn hơn áp suất khí quyển làm cho nước chảy ra khỏi ống.

Giải thích hiện tượng xảy ra ở bình A và B (hình 3):
- Ở bình A khi cá ngoi lên, thể tích cá tăng do bóng hơi to ra làm mực nước trong bình A dâng lên độ cao h1.
- Ở bình B khi cá lặn xuống đáy, thể tích cá giảm do bóng hơi xẹp lại làm mực nước trong bình B hạ xuống độ cao h2.
Tên thí nghiệm: tác dụng của bóng hơi.

- Hiện tượng: Xuất hiện khí màu vàng và giấy màu ẩm bị nhạt màu dần rồi mất màu
- Giải thích:
+ Khi nhỏ HCl đặc vào tinh thể KMnO4, sản phẩm tạo thành có khí chlorine:
2KMnO4 + 16HCl → 2MnCl2 + 2KCl + 5Cl2 + 8H2O
+ Khí chlorine tác dụng với nước ở giấy màu ẩm tạo thành hỗn hợp có tính tẩy màu: HCl và HClO
Cl2(aq) + H2O(l) \( \rightleftharpoons \) HCl(aq) + HClO(aq)
=> Dung dịch này còn được gọi là dung dịch nước chlorine, có tính tẩy màu, sát khuẩn

Bạn tham khảo câu trả lời của mình nha :
Ống (1) CH3 – CH2Br + H2O → CH3- CH2OH + HBr
AgNO3 + HBr → AgBr + HNO3
Ống (2) không có phản ứng, chứng tỏ liên kết C- Br trong phản ứng brombenzen rất bền

Hiện tượng: Cả 2 ống nghiệm đều xuất hiện kết tủa xanh lam nhạt (Cu(OH)2)
PTHH: CuSO4 + 2 NaOH → Cu(OH)2↓(xanh) + Na2SO4 (PTHH ở bước 2)
- Khi cho gylycerol vào ống 1: Kết tủa tan tạo thành dung dịch màu xanh lam của muối copper(II) glycerate
PTHH: 2 C3H5(OH)3 + Cu(OH)2→ [C3H5(OH)2O]2Cu + 2 H2O
- Khi cho ethanol vào ống 2: không có hiện tượng, kết tủa không tan.
Hiện tượng
-Khi cho vào hai ống nghiệm dung dịch CuSO4 thì sẽ xuất hiện kết tủa màu xanh lam
-Khi cho vào ống 1 glyxerol thì sẽ làm cho kết tủa tan dần tạo dần thành dung dịch màu xanh lam
-Khi cho etanol vào ống 2 thì kết tủa sẽ ko tan
PTHH:
\(CuSO_4+2NaOH\rightarrow Cu\left(OH\right)_2\downarrow+Na_2SO_4\)

1) Đinh sắt tan dần vào dung dịch, xuất hiện chất rắn màu đỏ, màu xanh của dung dịch ban đầu nhạt dần:
\(Fe+CuCl_2->FeCl_2+Cu\downarrow\)
2) Ban đầu không có hiện tượng, sau một thời gian, màu tím của dung dịch nhạt dần, có khí mùi sốc, màu vàng thoát ra:
NaOH + HCl --> NaCl + H2O
2KMnO4 + 16HCl --> 2KCl + 2MnCl2 +5 \(Cl_2\uparrow\) + 8H2O
- Hiện tượng:
+ Khi nhỏ hexane vào hai ống nghiệm chứa bromine, xuất hiện hai lớp chất lỏng trong 2 ống nghiệm, với lớp dưới màu vàng chứa bromine, lớp trên không màu chứa hexane.
+ Sau khi lắc đều, ống nghiệm được đưa ra nơi có ánh sáng mặt trời (hoặc được ngâm trong nước nóng 50oC) bị mất màu hoặc màu nhạt hơn so với ống nghiệm còn lại không được đưa ra nơi có ánh sáng mặt trời (hoặc được ngâm trong nước nóng 50oC).
- Giải thích:
+ Khi có mặt ánh sáng khuếch tán hoặc khi đun nóng, hexane tham gia phản ứng thế với bromine, làm dung dịch bromine nhạt màu dần hoặc mất màu.
+ Khi không có mặt ánh sáng khuếch tán hoặc không đun nóng, hexane không tham gia phản ứng thế với bromine, màu của dung dịch sau khi lắc ống nghiệm không thay đổi.