Cho 10,8 gam kim loại X tan hoàn toàn trong ddH2SO4 loãng dư. Sau thí nghiệm khối lượng dung dịch tăng thêm 9,6 gam. Xác định tên kim loại X?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: Ca + H2SO4 → CaSO4 + H2
PTHH: R + H2SO4 → RSO4 + H2
\(\Rightarrow M_X=\dfrac{9,6}{0,3}=32\left(g/mol\right)\)
Mà \(M_X=\dfrac{M_{Ca}+M_R}{2}=\dfrac{40+M_R}{2}\)
\(\Rightarrow\dfrac{40+M_R}{2}=32\Leftrightarrow40+M_R=64\Leftrightarrow M_R=24\)
Vậy R là kim loại magie (Mg)

\(a,n_A=\dfrac{2,7}{M_A}\left(mol\right)\\ n_{ACl_3}=\dfrac{13,35}{M_A+106,5}\)
PTHH: \(2A+6HCl\rightarrow2ACl_3+3H_2\)
\(\dfrac{2,7}{M_A}\)-------------->\(\dfrac{2,7}{M_A}\)
\(\rightarrow\dfrac{2,7}{M_A}=\dfrac{13,35}{M_A+106,5}\\ \Leftrightarrow M_A=27\left(g\text{/}mol\right)\)
=> A là Al
\(b,n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: \(2M+2nHCl\rightarrow2MCl_n+nH_2\) (n là hoá trị của M, n ∈ N*)
\(\dfrac{0,4}{n}\)<---------------------------0,2
\(\rightarrow M_M=\dfrac{4,8}{\dfrac{0,2}{n}}=12n\left(g\text{/}mol\right)\)
Vì n là hoá trị của M nên ta có bảng
| n | 1 | 2 | 3 |
| MM | 12 | 24 | 36 |
| Loại | Mg | Loại |
Vậy M là Mg

\(n_{H_2\left(dktc\right)}=\dfrac{V}{22,4}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\\ PTHH:2A+3H_2SO_4->A_2\left(SO_4\right)_3+3H_2\)
tỉ lệ 2 : 3 : 1 : 3
n(mol) 0,1<------0,15<------------0,05<-------0,15
\(=>M_A=\dfrac{m}{n}=\dfrac{2,7}{0,1}=27\left(g/mol\right)\)
`=>A` là nhôm
`=>` muối là `Al_2 (SO_4)_3`
\(m_{Al_2\left(SO_4\right)_3}=n\cdot M=0,05\cdot342=17,1\left(g\right)\)
a, \(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PT: \(2A+3H_2SO_4\rightarrow A_2\left(SO_4\right)_3+3H_2\)
Theo PT: \(n_A=\dfrac{2}{3}n_{H_2}=0,1\left(mol\right)\Rightarrow M_A=\dfrac{2,7}{0,1}=27\left(g/mol\right)\)
→ A là nhôm.
b, Theo PT: \(n_{Al_2\left(SO_4\right)_3}=\dfrac{1}{3}n_{H_2}=0,05\left(mol\right)\Rightarrow m_{Al_2\left(SO_4\right)_3}=0,05.342=17,1\left(g\right)\)

\(n_{H_2SO_4}=\dfrac{294.20}{100.98}=0,6\left(mol\right)\)
PTHH: 2R + 3H2SO4 --> R2(SO4)3 + 3H2
_____0,4<---0,6
=> \(M_R=\dfrac{10,8}{0,4}=27\left(g/mol\right)=>Al\)

Dựa vào bảng tuần hoàn ta tìm được X là Al và Y là Fe.
Gọi số mol các chất trong hỗn hợp: Al = a( mol); Fe = b (mol).
Ta có: 27a + 56b = 8,3 (1)
2Al + 6HCl → 2AlCl3 + 3H2 (2)
a 3a 1,5a
Fe + 2HCl → FeCl2 + H2 (3)
b 2b b
Khối lượng dung dịch sau phản ứng tăng thêm 7,8 gam nên: 8,3 - mH2 = 7,8.
Vậy: mH2 = 0,5 gam → nH2 = 0,25 mol → 1,5a + b = 0,25 (4)
Từ (1) và (4) ta tìm được: a = 0,1 mol; b = 0,1 mol.
mAl = 27.0,1 = 2,7 (gam)
mFe = 56.0,1 = 5,6 (gam);
VHCl = (3a + 2b) : 0,5 = 1 (lit).

Đáp án B
Do thêm kim loại M vào dung dịch F e 2 S O 4 3 , khối lượng dung dịch tăng đúng bằng khối lượng kim loại phản ứng nên sau phản ứng không thu được kết tủa cũng không có khí thoát ra.
Vậy M là Cu.
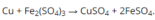

Đáp án B
Do thêm kim loại M vào dung dịch F e 2 S O 4 3 , khối lượng dung dịch tăng đúng bằng khối lượng kim loại phản ứng nên sau phản ứng không thu được kết tủa cũng không có khí thoát ra.
Vậy M là Cu
![]()
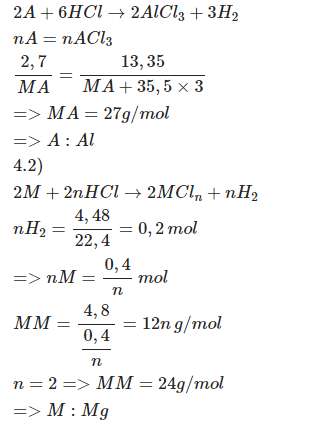
Gọi n là hoá trị của kim loại X
\(n_{H_2}=nn_X=\dfrac{10,8n}{X}\left(mol\right)\\ \Delta m_{dd}=10,8-2\cdot\dfrac{10,8n}{X}=9,6\\ n=\dfrac{1,2}{2.10,8}X=\dfrac{1}{18}X\)
X là kim loại mà X = 18n nên X là nguyên tố khí hiếm (vô lý)
Vậy không có kim loại X thoả đề