Cho 5,56g hỗn hợp A gồm Fe và kim loại M ( hóa trị không đổi) . Chia A thành 2 phần bằng nhau
Phần 1 : Hòa tan hết trong dd HCl được 1,568 lít khí H2(đktc)
Phần 2 : Tác dụng vừa đủ với 2,016 lít khí Cl2 ( đktc) . Xác định kim loại M? Giúp mình vớii
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi hóa trị của M là n
Gọi nMg = x mol ⇒ nFe = 3.x mol
Số mol H2 là: nH2 = 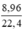 = 0,4 (mol)
= 0,4 (mol)
Số mol Cl2 là: nCl2 = 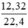 = 0,55 (mol)
= 0,55 (mol)
Các PTHH
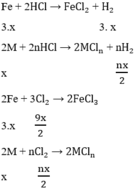
Theo bài ra ta có hệ phương trình:
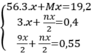
Giải hệ pt ⇒ x = 0,1 mol ⇒ n = 2 ⇒ M = 24
Vậy M là Mg
nMg = 0,1 mol ⇒ nFe = 0,3 mol
Thành phần % theo khối lượng
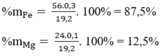

- Phần 1: \(n_{H_2}=\dfrac{1,344}{22,4}=0,06\left(mol\right)\)
Gọi \(\left\{{}\begin{matrix}n_{Al}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\end{matrix}\right.\left(a,b>0\right)\)
PTHH:
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
a--------------------------->1,5a
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
b--------------------------->b
\(\Rightarrow1,5a+b=0,06\left(1\right)\)
- Phần 2: Đặt hệ số tỉ lệ \(\dfrac{P_2}{P_1}=k\)
\(\Rightarrow\left\{{}\begin{matrix}n_{Al}=ak\left(mol\right)\\n_{Fe}=bk\left(mol\right)\end{matrix}\right.\Rightarrow ak+bk=0,15\left(2\right)\)
\(n_{H_2}=\dfrac{2,016}{22,4}=0,09\left(mol\right)\)
PTHH: \(2Al+2KOH+2H_2O\rightarrow2KAlO_2+3H_2\)
0,06<----------------------------------------0,09
\(\Rightarrow ak=0,06\left(3\right)\)
Từ \(\left(1\right),\left(2\right),\left(3\right)\Rightarrow\left\{{}\begin{matrix}a=0,02\\b=0,03\\k=3\end{matrix}\right.\)
\(\Rightarrow m=\left(0,02.27+0,03.56\right)\left(3+1\right)=8,88\left(g\right)\)

Chọn đáp án A
Vì hóa trị các kim loại không đổi nên số mol e nhường nhận trong hai thí nghiệm như nhau
Và bte-> mol e=0,15.2=0,3=>mol No=0,1=>V=2,24l
Gọi: \(\left\{{}\begin{matrix}n_{Fe}=x\left(mol\right)\\n_M=y\left(mol\right)\end{matrix}\right.\) (trong 1 phần) ⇒ 56x + MM.y = 5,56:2 (1)
Giả sử M có hóa trị n không đổi.
- Phần 2: \(n_{Cl_2}=\dfrac{2,016}{22,4}=0,09\left(mol\right)\)
PT: \(2Fe+3Cl_2\underrightarrow{t^o}2FeCl_3\)
\(2M+nCl_2\underrightarrow{t^o}2MCl_n\)
Theo PT: \(n_{Cl_2}=\dfrac{3}{2}n_{Fe}+\dfrac{n}{2}n_M=\dfrac{3}{2}x+\dfrac{n}{2}y=0,09\left(2\right)\)
- Phần 1: \(n_{H_2}=\dfrac{1,568}{22,4}=0,07\left(mol\right)\)
+ TH1: M có pư với HCl.
PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(2M+2nHCl\rightarrow2MCl_n+nH_2\)
Theo PT: \(n_{H_2}=n_{Fe}+\dfrac{n}{2}n_M=x+\dfrac{n}{2}y=0,07\left(3\right)\)
Từ (2) và (3) \(\Rightarrow\left\{{}\begin{matrix}x=0,04\left(mol\right)\\ny=0,06\end{matrix}\right.\)
Thay vào (1), ta được: \(M_M.y=0,54\) \(\Rightarrow\dfrac{M_M.y}{n.y}=\dfrac{0,54}{0,06}\Rightarrow M_M=9n\)
Với n = 3 thì MM = 27 (g/mol) là thỏa mãn.
→ M là Al.
+ TH2: M không pư với HCl.
PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
Theo PT: \(x=n_{Fe}=n_{H_2}=0,07\left(mol\right)\)
Thay vào (1) ta được \(M_M.y=-1,14\) (vô lý vì MM và y đều là số dương)
Vậy: M là Al.