Đốt cháy hoàn toàn 2,4 g chất hữu cơ A, dẫn toàn bộ sản phẩm cháy thu được lần lượt qua các bình H2SO4 đặc và Ba(OH)2 dư thì thấy các bình tăng lần lượt là 5,4 g và 6,6 g xác định công thức phân tử của a biết tỉ khối hơi của A so với khí oxi là 0,5 Giải giúp mình với! Mình cảm ơn
K
Khách
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Những câu hỏi liên quan

6 tháng 8 2017
Gọi công thức phân tử của X là CxHyOz .
Sản phẩm cháy gồm CO2 và H2O.
Ở lần thí nghiệm thứ nhất, bình 1 chứa H2SO4 đậm đặc dư hấp thụ H2O và bình 2 chứa dung dịch nước vôi trong dư hấp thụ CO2.
Ở lần thí nghiệm thứ hai, bình 1 chứa CaO dư hấp thụ CO2 và toàn bộ hơi nước, bình 2 chứa P2O5 dư không hấp thụ gì vì toàn bộ lượng khí đã được hấp thụ ở bình 1. Do đó m2 = 0. Theo định luật bảo toàn khối lượng ta có
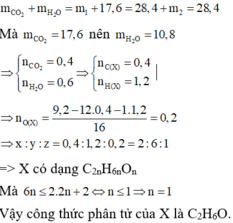

1 tháng 2 2019
Đáp án A
nCO2=nCaCO3=35/100=0,35 mol
nH2O=3,6/18=0,2 mol
=>mO=mX-mC-mH=5,4 -12.0,35-1.2.0,2=0,8 g
=> nO=0,05 mol
nC:nH:nO=0,35:0,4:0,05=7:8:1
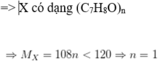
=> CTPT của X là C7H8O
X phản ứng với Na suy ra X có nhóm -OH => Các CTCT của X là
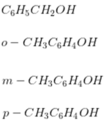
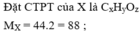
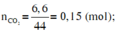
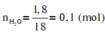



Ta có: \(\left\{{}\begin{matrix}m_{H_2O}=5,4\left(g\right)\\m_{CO_2}=6,6\left(g\right)\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}n_{H_2O}=\dfrac{5,4}{18}=0,3\left(mol\right)\\n_{CO_2}=\dfrac{6,6}{44}=0,15\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}n_H=2n_{H_2O}=0,6\left(mol\right)\\n_C=n_{CO_2}=0,15\left(mol\right)\end{matrix}\right.\)
`=> m_C + m_H = 0,15.12 + 0,6 = 2,4 (g) = m_A`
`=> A` không chứa O
\(M_A=0,5.32=16\left(g/mol\right)\)
Ta có: \(n_C:n_H=0,15:0,6=1:4\)
`=>` CTPT của A có dạng \(\left(CH_4\right)_n\)
\(\Rightarrow n=\dfrac{16}{16}=1\)
Vậy A là CH4