Cho 320 ml dung dịch HCl tác dụng với 1,384 gam hỗn hợp kim loại Mg, Al, Cu thì thấy vừa đủ hoà tan các kim loại hoạt động và thu đuợc 358,4 ml khi H2 (dktc). Cho kim loại Cu không tan ở trên tác dụng hết với oxi, rồi hoà tan oxit thu được thì cũng cần một lượng axít vừa dùng như trên. a) Viết các phương trình phản ứng và tinh khối lượng mỗi kim loại có trong hỗn hợp. b) Tính nồng độ Cm của dung dịch axít HCl đã dùng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Do Cu ko phản ứng với HCl ở điều kiện thường
=> 6,72 lít khí là sản phẩm của Al tác dụng với HCl
Ta có: nH2 = 6,72 / 22,4 = 0,3 mol
PTHH: 2Al + 6HCl ===> 2AlCl3 + 3H2
0,2 <== 0,3
=> mAl = 0,2 x 27 = 5,4 gam
Và 3,2 gam chất rắn ko tan chính là Cu
Khi cho hỗn hợp trên tác dụng với H2SO4 đặc nóng
PTHH 3Al + 6H2SO4(đ, nóng) ===> Al2(SO4)3 + 3SO2 + 6H2O
0,2 0,2
Cu + 2H2SO4 ===> CuSO4 + SO2 + 2H2O
0,05 0,05
nCu = 3,2 / 64 = 0,05 mol
=> VSO2 (đktc)= (0,05 + 0,2) x 22,4 = 5,6 lít

Đáp án A
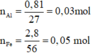
Sau phản ứng thu được 3 kim loại => Fe còn dư; Al, AgNO3 và Cu(NO3)2 đều phản ứng hết; 3 kim loại thu được gồm Ag, Cu và Fe dư.
![]()
Đặt số mol của AgNO3 và Cu(NO3)2 lần lượt là a, b
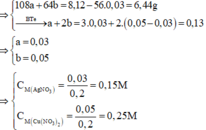

\(n_O=\dfrac{33,3-21,3}{16}=0,75\left(mol\right)\)
=> nH2O = 0,75 (mol)
Giả sử có V lít dd
=> \(\left\{{}\begin{matrix}n_{H_2SO_4}=V\left(mol\right)\\n_{HCl}=2V\left(mol\right)\end{matrix}\right.\)
Bảo toàn H: 2V + 2V = 0,75.2
=> V = 0,375 (lít) = 375 (ml)
a, PT: \(Mg+2HCl\rightarrow MgCl_2+H_2\) (1)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\) (2)
\(2Cu+O_2\underrightarrow{t^o}2CuO\) (3)
\(CuO+2HCl\rightarrow CuCl_2+H_2O\) (4)
Gọi: \(\left\{{}\begin{matrix}n_{Mg}=x\left(mol\right)\\n_{Al}=y\left(mol\right)\\n_{Cu}=z\left(mol\right)\end{matrix}\right.\) ⇒ 24x + 27y + 64z = 1,384 (1)
Ta có: \(n_{H_2}=\dfrac{0,3584}{22,4}=0,016\left(mol\right)\)
Theo PT: \(n_{H_2}=n_{Mg}+\dfrac{3}{2}n_{Al}=x+\dfrac{3}{2}y=0,016\left(2\right)\)
\(n_{HCl\left(\left(1\right)+\left(2\right)\right)}=2n_{H_2}=0,032\left(mol\right)=n_{HCl\left(4\right)}\) \(n_{Cu}=n_{CuO}=\dfrac{1}{2}n_{HCl\left(4\right)}=0,016=z\left(3\right)\)
Từ (1), (2) và (3) \(\Rightarrow\left\{{}\begin{matrix}x=0,012\left(mol\right)\\y=\dfrac{1}{375}\left(mol\right)\\z=0,016\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Mg}=0,012.24=0,288\left(g\right)\\m_{Al}=\dfrac{1}{375}.27=0,072\left(g\right)\\m_{Cu}=0,016.64=1,024\left(g\right)\end{matrix}\right.\)
b, \(C_{M_{HCl}}=\dfrac{0,032}{0,32}=0,1\left(M\right)\)