\(\text{Đốt cháy hoàn toàn 6,8 gam hợp chất A trong oxi không khí (vừa đủ) thì chỉ thu được 14,2 gam }\)\(P_2O_5\) \(và\) \(5,4\) \(gam\) \(hơi\) \(nước\)
a, Tính thể tích không khí đã dùng (đktc), biết oxi chiếm 1/5 thể tích không khí.
b, Hợp chất A có chứa những nguyên tố nào? Vì sao?
c, Xác định công thức đơn giản nhất của hợp chất A.

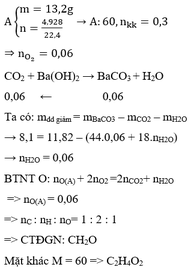
 mol
mol
a, Theo ĐLBT KL, có: mA + mO2 = mP2O5 + mH2O
⇒ mO2 = 14,2 + 5,4 - 6,8 =12,8 (g) \(\Rightarrow n_{O_2}=\dfrac{12,8}{32}=0,4\left(mol\right)\)
\(\Rightarrow V_{O_2}=0,4.22,4=8,96\left(l\right)\)
Mà: O2 chiếm 1/5 thể tích không khí.
\(\Rightarrow V_{kk}=\dfrac{8,96}{\dfrac{1}{5}}=44,8\left(l\right)\)
b, - Đốt A thu P2O5 và H2O → A chứa P và H, có thể có O.
Ta có: \(n_{P_2O_5}=\dfrac{14,2}{142}=0,1\left(mol\right)\Rightarrow n_P=0,1.2=0,2\left(mol\right)\)
\(n_{H_2O}=\dfrac{5,4}{18}=0,3\left(mol\right)\Rightarrow n_H=0,3.2=0,6\left(mol\right)\)
⇒ mP + mH = 0,2.31 + 0,6.1 = 6,8 (g) = mA
Vậy: A chỉ có P và H.
c, Gọi CTPT của A là PxHy.
⇒ x:y = 0,2:0,6 = 1:3
→ CTĐGN của A là PH3.