Cho 2.7 gam nhôm vào 100ml dung dịch H2So4 0.3 M a) Viết phương trình hoá học b) Sau phản ứng chất nào dư? Số mol dư là bao nhiêu? c) Tính thể tích khí H2 sinh ra sau phản ứng (đktc)
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


1.nH2=5.04/22.4=0.225mol
Đặt x,y lần lượt là số mol của Al,Mg
a)2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
x 3/2 x
Mg+ H2SO4 --> MgSO4 + H2
y y
b) theo đề, ta có hệ pt: 27x + 24y= 4.5
1.5x + y =0.225
giải hệ pt trên,ta có :x=0.1 ; y=0.075
thay vào pt,suy ra :
mAl=0.1*27=2.7g =>%Al=(2.7/4.5)*100=60%
=>%Mg=40%
vậy % của Al,Mg lần lượt là 60% và 40%
2.nAl=5.4/27=0.2mol
nH2SO4=0.5*0.1=0.05 mol
pt:2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
0.2 0.05 0.02 0.05
a)theo pt, ta thấy Al dư
VH2=0.05*22.4=1.12 l
b)CMAl2(SO4)3= 0.02/0.1=0.2M
Bài này không khó đâu nh,tính theo pthh thôi à.
Chúc em học tốt!!!:))

nZn=19,5/65=0,3(mol)
mHCl=18,25/36,5=0,5(mol)
pt: Zn+2HCl--->ZnCl2+H2
1______2
0,3_____0,5
Ta có: 0,3/1>0,5/2
=>Zn dư
mZn dư=0,05.65=3,25(mol)
Theo pt: nH2=1/2nHCl=1/2.0,5=0,25(mol)
=>VH2=0,25.22,4=5,6(l)
nZn = 0,3 mol
nHCl = 0,5 mol
Zn + 2HCl → ZnCl2 + H2
Đặt tỉ lệ ta có
0,3 < \(\dfrac{0,52}{2}\)
⇒ Zn dư và dư 3,25 gam
⇒ VH2 = 0,25.22,4 = 5,6 (l)

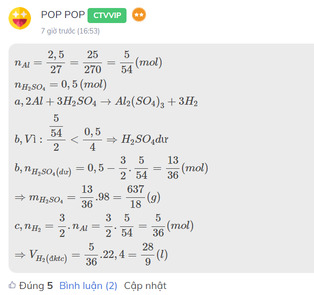
\(n_{Al}=\dfrac{2,5}{27}=\dfrac{25}{270}=\dfrac{5}{54}\left(mol\right)\\ n_{H_2SO_4}=0,5\left(mol\right)\\ a,2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\\ b,Vì:\dfrac{\dfrac{5}{54}}{2}< \dfrac{0,5}{4}\Rightarrow H_2SO_4dư\\ b,n_{H_2SO_4\left(dư\right)}=0,5-\dfrac{3}{2}.\dfrac{5}{54}=\dfrac{13}{36}\left(mol\right)\\ \Rightarrow m_{H_2SO_4}=\dfrac{13}{36}.98=\dfrac{637}{18}\left(g\right)\\ c,n_{H_2}=\dfrac{3}{2}.n_{Al}=\dfrac{3}{2}.\dfrac{5}{54}=\dfrac{5}{36}\left(mol\right)\\ \Rightarrow V_{H_2\left(đktc\right)}=\dfrac{5}{36}.22,4=\dfrac{28}{9}\left(l\right)\)

a: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
b: \(n_{Al}=\dfrac{2.5}{27}< \dfrac{1}{4}\)
=>H2SO4 dư, Al đủ
\(m_{H_2SO_4}=0.25\cdot98=24.5\left(g\right)\)
c: \(n_{Al_2\left(SO_4\right)_3}=\dfrac{2.5}{54}=\dfrac{5}{108}\left(mol\right)\)
\(\Leftrightarrow n_{H_2}=\dfrac{5}{36}\left(mol\right)\)
\(V_{H_2}=\dfrac{5}{36}\cdot22.4=\dfrac{28}{9}\left(lít\right)\)
Mình thấy bạn Thịnh tính lượng dư sai
Đây là bài mình từng làm, bạn tham khảo nhé!

Zn+2HCl->ZnCl2+H2
0,125-0,25---0,125-0,125
n HCl=\(\dfrac{9,125}{36,5}\)=0,25 mol
=>Zn dư
=>m Zn dư=(0,15-0,125).65=1,625 mol
=>VH2=0,125.22,4=2,8l
=>m ZnCl2=0,125.136=17g
nHCl = 9,125/36,5 = 0,25 (mol)
PTHH: Zn + 2HCl -> ZnCl2 + H2
LTL: 0,15 > 0,25/2 => Zn dư
nZn (p/ư) = nZnCl2 = nH2 = 0,25/2 = 0,125 (mol)
mZn (dư) = (0,15 - 0,125) . 65 = 1,625 (g)
VH2 = 0,125 . 22,4 = 2,8 (l)
mZnCl2 = 0,125 . 136 = 17 (g)

PTHH: \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\uparrow\)
Làm gộp các phần còn lại
Ta có: \(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\) \(\Rightarrow\left\{{}\begin{matrix}n_{Al_2\left(SO_4\right)_3}=0,1mol\\n_{H_2SO_4}=n_{H_2}=0,3mol\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}V_{H_2}=0,3\cdot22,4=6,72\left(l\right)\\m_{Al_2\left(SO_4\right)_3}=0,1\cdot342=34,2\left(g\right)\\m_{H_2SO_4}=0,3\cdot98=29,4\left(g\right)\end{matrix}\right.\)

nAl =5.4275.427=0.2 (mol) đổi 200ml = 0,2l
nH2SO4 = Cm.V =1,35.0,2=0,27(MOL)
2Al + 3H2SO4→→Al2(SO4)3 + 3H2
pt; 2 ; 3 : 1 : 3
đb; 0.18 : 0.27 : 0.09 : 0.27 (mol)
so sánh nAl =0.220.22>nH2SO4 =0.2730.273
a, nAl dư = 0.2-0.18=0.02(mol)
m Al dư = 0,02.27=0.54(g)
b, VHH22=0,27.22,4 = 6,048(l)
c, dd tạo thành sau pư là Al2(SO4)3
Cm Al2(SO4)3 = nVnV=0.090.20.090.2=0.45

nFe = 2.8/56 = 0.05 (mol)
nHCl = 14.6/36.5 = 0.4 (mol)
Fe + 2HCl => FeCl2 + H2
1.........2
0.05......0.4
LTL : 0.05/1 < 0.4/2
=> HCl dư
mHCl (dư) = ( 0.4 - 0.1 ) * 36.5 = 10.95 (g)
VH2 = 0.05*22.4 = 1.12 (l)
nHCl (dư) = 0.4 - 0.1 = 0.3 (mol)
mFe cần thêm = 0.3/2 * 56 = 8.4 (g)

a) \(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right);n_{H_2SO_4}=0,2.2=0,4\left(mol\right)\)
PTHH: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
Ban đầu: 0,2 0,4
Sau pư: 0 0,2 0,2 0,2
`=> V_{H_2} = 0,2.22,4 = 4,48(l)`
`b) m_{H_2SO_4(dư)} = 0,2.98 = 19,6(g)`
`c)` \(C_{M\left(FeSO_4\right)}=C_{M\left(H_2SO_4.d\text{ư}\right)}=\dfrac{0,2}{0,2}=1M\)
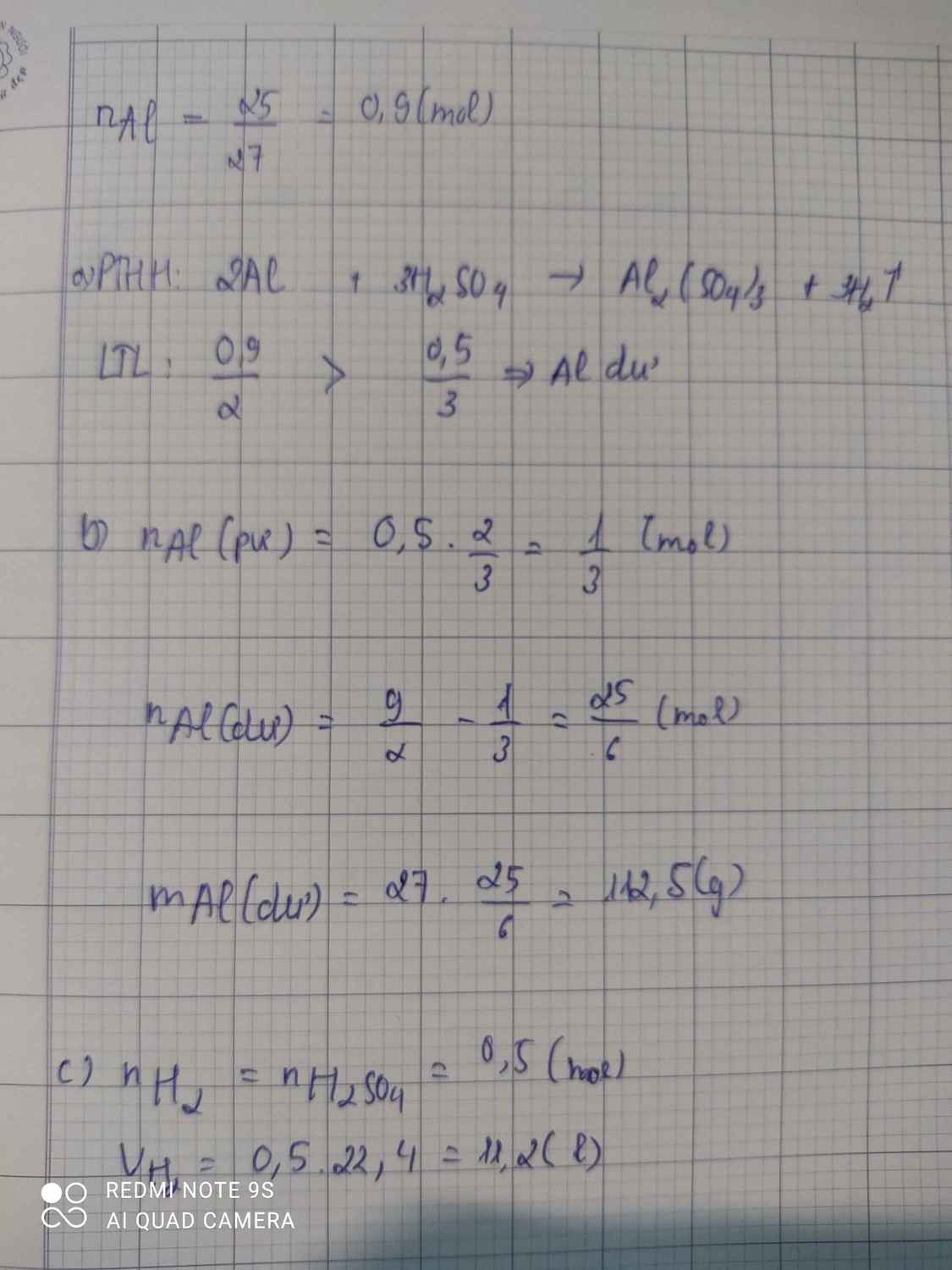
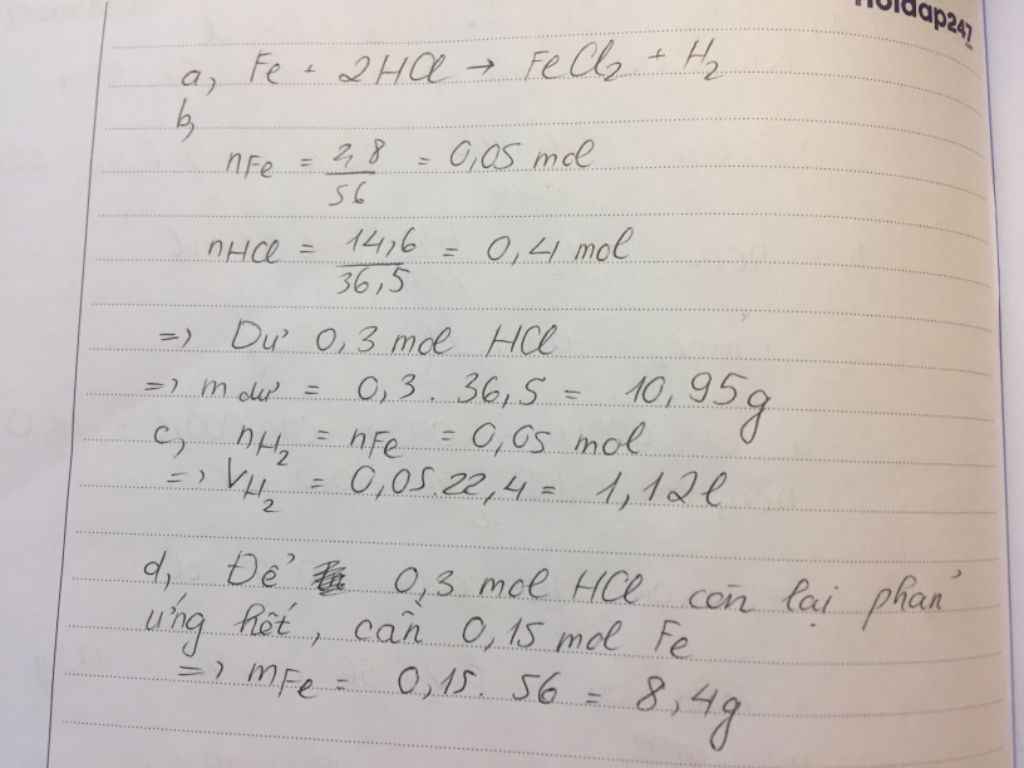
a) \(n_{Al}=\dfrac{2,7}{27}=0,1\left(mol\right);n_{H_2SO_4}=0,3.1=0,03\left(mol\right)\)
PTHH: 2Al + 3H2SO4 ---> Al2(SO4)3 + 3H2
b) Xét tỉ lệ: \(\dfrac{0,1}{2}>\dfrac{0,03}{3}\) => Al dư, H2SO4 hết, tính theo H2SO4
Theo PTHH: \(n_{Al\left(p\text{ư}\right)}=\dfrac{2}{3}.n_{H_2SO_4}=\dfrac{2}{3}.0,03=0,02\left(mol\right)\)
`=>` \(n_{Al\left(d\text{ư}\right)}=0,1-0,02=0,08\left(mol\right)\)
c) Theo PTHH: \(n_{H_2}=n_{H_2SO_4}=0,03\left(mol\right)\)
`=>` \(V_{H_2}=0,03.22,4=0,672\left(l\right)\)
0,3.1 sao bằng 0,03 dạ