Đốt cháy một hợp chất hữu cơ có 6 nguyên tử cacbon trong phân tử thu được hỗn hợp sản phâm CO2 và nước theo tỉ lệ mol 1:1. Hợp chất đó có thể là hợp chất nào trong các hợp chất dưới đây. Biết rằng số mol oxi tiêu thụ bằng số mol CO2 thu được?
K
Khách
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.
Những câu hỏi liên quan

7 tháng 1 2018
Đáp án B. Glucozơ
Khi đốt cháy: nCO2 = nH2O → hợp chất đó có dạng CnH2nOm
Mà chất này có thể lên men rượu → chất đó phải là gluczo
PTHH:
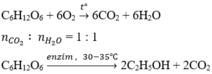

31 tháng 8 2021
Chọn B
\(C_6H_{12}O_6+6O_2\underrightarrow{to}6CO_2+6H_2O\)
\(C_6H_{12}O_6\left(glucozo\right)\) \(\underrightarrow{^{30-35^oC,men.rượu}}\) \(2CO_2+2C_2H_5OH\)

1 tháng 10 2017
Đáp án D
Y+O2:Áp dụng định luật bảo toàn khối lượng có:
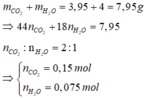
Áp dụng định luật bảo toàn nguyên tố O có:

Þ Công thức đơn giản nhất hay công thức phân tử của Y là C6H6O5
Y phản ứng được với NaOH theo tỉ lệ mol tương ứng 1: 2
Þ CTCT của Y là
![]()
A đúng, CTCT của X
![]()
Tổng số nguyên tử H của X và Y = 2+6=8
B đúng.
C đúng.
D sai. X không có đồng phân hình học.
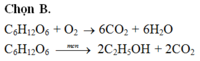




Giả sử có 1 mol chất hữu cơ
=> \(n_C=6\left(mol\right)\)
BTNT C: \(n_{CO_2}=n_C=6\left(mol\right)\)
Ta có: \(n_{CO_2}:n_{H_2O}=1:1\Rightarrow n_{H_2O}=n_{CO_2}=6\left(mol\right)\)
BTNT H: \(n_H=2n_{H_2O}=12\left(mol\right)\)
Lại có: \(n_{O_2}=n_{CO_2}=6\left(mol\right)\)
BTNT O: \(n_{O\left(hchc\right)}+2n_{O_2}=2n_{CO_2}+n_{H_2O}\)
=> \(n_{O\left(hchc\right)}=6.2+6-6.2=6\left(mol\right)\)
Trong 1 mol hchc có \(\left\{{}\begin{matrix}n_C=6\left(mol\right)\\n_H=12\left(mol\right)\\n_O=6\left(mol\right)\end{matrix}\right.\)
Vậy CTHH của hợp chất là C6H12O6