Cho 10gam hỗn hợp Al và Al2O3 td vs dd NaOH dư, thu được 6.72 lít khí H2 (đktc). Phần trăm khối lượng của Al2O3 trong hỗn hợp là
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án C
nH2 = 13,44: 22,4 = 0,6 mol
- Các phản ứng:
Al2O3 + 2NaOH → 2NaAlO2 + H2O
Al + NaOH → NaAlO2 + 1,5H2
Mol: 0,4 ← 0,6
=> %mAl = 0,4.27 / 31,2 = 34,6%
=> %mAl2O3 = 100 % - %mAl = 100% - 34,6% = 65,4%

\(n_{H_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
\(2A1+2NAOH+2H_2O-2NaA10_2+H_2O\)
\(AI_2O_3=2NaOH+2NaOHA10_2+H_2O\)
\(n_{AI}=\dfrac{2}{3}n_{H_2}=\dfrac{2}{3}.0,6=0,4\left(mol\right)\)
\(m_{AI}=27.0,4=10,8\left(gam\right);mAI_2O_3=31,2-10,8=20,4\left(gam\right)\)
Biết làm mỗi câu A

Đáp án B
Z chắc chắn phải chứa CO2. Lại có MZ = 44 = MCO2 ⇒ khí còn lại cũng có M = 44.
⇒ Khí còn lại là N2O || NaOH + Y → ↓ rồi nung ⇒ chỉ có MgO ⇒ nMg2+ = 0,34 mol.
► Ta có sơ đồ sau:

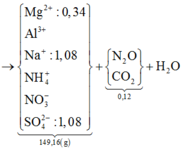
Bảo toàn khối lượng: mH2O = 11,16(g) ⇒ nH2O = 0,62 mol. Bảo toàn nguyên tố Hidro:
⇒ nNH4+ = (1,08 + 0,32 - 0,62 × 2) ÷ 4 = 0,04 mol || Đặt nAl3+ = x; nNO3– = y
⇒ mmuối = 27x + 62y + 137,4 = 149,16(g) || Bảo toàn điện tích: 3x - y = 0,36 mol.
► Giải hệ có: x = 0,16 mol; y = 0,12 mol. Bảo toàn nguyên tố Nitơ: nN2O = 0,08 mol.
⇒ nMgCO3 = nCO2 = 0,04 mol. Bảo toàn nguyên tố Mg: nMg = 0,32 mol.
● ∑nH+ = 10nNH4+ + 10nN2O + 2nO + 2nCO3 ⇒ nO = 0,06 mol
⇒ nAl2O3 = 0,02 mol ||⇒ %mAl2O3 = 0,02 × 102 ÷ 15,84 × 100% = 12,88%
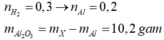

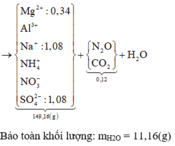

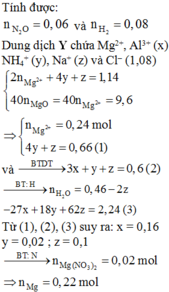
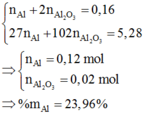
2Al+2NaOH+2H2O->2NaAlO2+3H2
0,2---------------------------------------0,3
Al2O3+2NaOH->2NaAlO2+H2O
n H2=\(\dfrac{6,72}{22,4}=0,3mol\)
=>%mAl=\(\dfrac{0,2.27}{10}.100=54\text{%}\)
=>%mAl2O3=46%