Thả một mảnh kẽm 13g vào 18,25g dung dịch HCl 50%. a) tính khối lượng Zn phản ứng. Khối lượng H2 tạo thành? b) Tính C% của các chất có trong dung dịch sau phản ứng.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a, Zn + 2HCl ---> ZnCl2 + H2
b, nZn=\(\dfrac{13}{65}=0,2mol\)
Ta có: 1 mol Zn ---> 1 mol H2
nên 0,2 mol Zn ---> 0,2 mol H2
VH2=0,2.22,4=4,48 mol

a) \(Zn+2HCl\rightarrow ZnCl_2+H_2\)
nZn = \(\dfrac{13}{65}=0,2mol\)
Theo pt: nH2 = nZn = 0,2 mol
=> VH2 = 0,2.22,4 = 4,48 lít
b) Theo pt: nZnCl2 = nZn = 0,2 mol
=> mZnCl2 = 0,2.136 = 27,2g

1) nZn=13/65=0,2(mol)
PTHH: Zn + 2 HCl -> ZnCl2 + H2
nH2=nZnCl2=nZn=0,2(mol)
nHCl=2.0,2=0,4(mol)
=> mHCl=0,4 x 36,5=14,6(g)
=> mddHCl=(14,6.100)/8=182,5(g)
2) V(H2,đktc)=0,2 x 22,4= 4,48(l)
mZnCl2=0,2.136=27,2(g)
3) mddsau=mZn+mddHCl - mH2= 13+182,5-0,2.2=195,1(g)
4) C%ddZnCl2=(27,2/195,1).100=13,941%

\(n_{Zn}=\dfrac{13}{65}=0,2mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,2 0,4 0,2 ( mol )
\(m_{HCl}=0,4.36,5=14,6g\)
\(m_{ddHCl}=\dfrac{14,6\times100}{14,6}=100g\)
\(m_{ddspứ}=100+13=113g\)
\(m_{ZnCl_2}=0,2.136=27,2g\)
\(C\%_{ZnCl_2}=\dfrac{27,2}{113}.100=24,07\%\)

\(n_{Zn}=\dfrac{13}{65}=0,2mol\)
\(n_{HCl}=\dfrac{18,25}{36,5}=0,5mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,2 0,5 0 0
0,2 0,4 0,2 0,2
0 0,1 0,2 0,2
Sau phản ứng, axit HCl còn dư và dư \(m=0,1\cdot36,5=3,65g\)
\(m_{ZnCl_2}=0,2\cdot136=27,2g\)
\(V_{H_2}=0,2\cdot22,4=4,48l\)

a, \(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
Zn + 2HCl -----> ZnCl2 + H2
0,2 0,4 0,2 0,2
b, \(m_{Zn}=0,2.65=13\left(g\right)\)
\(m_{HCl}=0,4.36,5=14,6\left(g\right)\)
c, \(m_{ZnCl_2}=0,2.136=27,2\left(g\right)\)
\(a,n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: Zn + 2HCl ---> ZnCl2 + H2
0,2<--0,4<--------0,2<---0,2
\(b,\left\{{}\begin{matrix}m_{Zn}=0,1.65=13\left(g\right)\\m_{HCl}=0,4.36,5=14,6\left(g\right)\end{matrix}\right.\\ c,m_{ZnCl_2}=0,2.136=27,2\left(g\right)\)

\(Zn+2HCl\rightarrow ZnCl_2+H_2\\ n_{HCl}=0,3.0,15=0,045\left(mol\right)\\ n_{Zn}=n_{H_2}=\dfrac{0,045}{2}=0,0225\left(mol\right)\\ a,m_{Zn}=0,0225.65=1,4625\left(g\right)\\ b,V_{H_2\left(đktc\right)}=22,4.0,0225=0,504\left(l\right)\\ c,n_{Zn}=\dfrac{19,5}{65}=0,3\left(mol\right)\\ Vì:\dfrac{0,3}{1}>\dfrac{0,045}{2}\Rightarrow Zndư\\ \Rightarrow n_{ZnCl_2}=\dfrac{0,045}{2}=0,0225\left(mol\right)\\ m_{ZnCl_2}=0,0225.136=3,06\left(g\right)\)

\(n_{Zn}=\dfrac{13}{65}=0.2\left(mol\right)\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(0.2....................0.2..........0.2\)
\(m_{ZnCl_2}=0.2\cdot136=27.2\left(g\right)\)
\(V_{H_2}=0.2\cdot22.4=4.48\left(l\right)\)

\(n_{H_2}=\dfrac{4.48}{22.4}=0.2\left(mol\right)\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
\(0.2.......0.4.......................0.2\)
\(m_{Zn}=0.2\cdot65=13\left(g\right)\)
\(C\%_{HCl}=\dfrac{0.4\cdot36.5}{200}\cdot100\%=7.3\%\)
\(n_{CuO}=\dfrac{24}{80}=0.3\left(mol\right)\)
\(CuO+H_2\underrightarrow{^{t^0}}Cu+H_2O\)
\(1..........1\)
\(0.3.........0.2\)
\(LTL:\dfrac{0.3}{1}>\dfrac{0.2}{1}\Rightarrow CuOdư\)
\(m_{CuO\left(dư\right)}=\left(0.3-0.2\right)\cdot64=6.4\left(g\right)\)


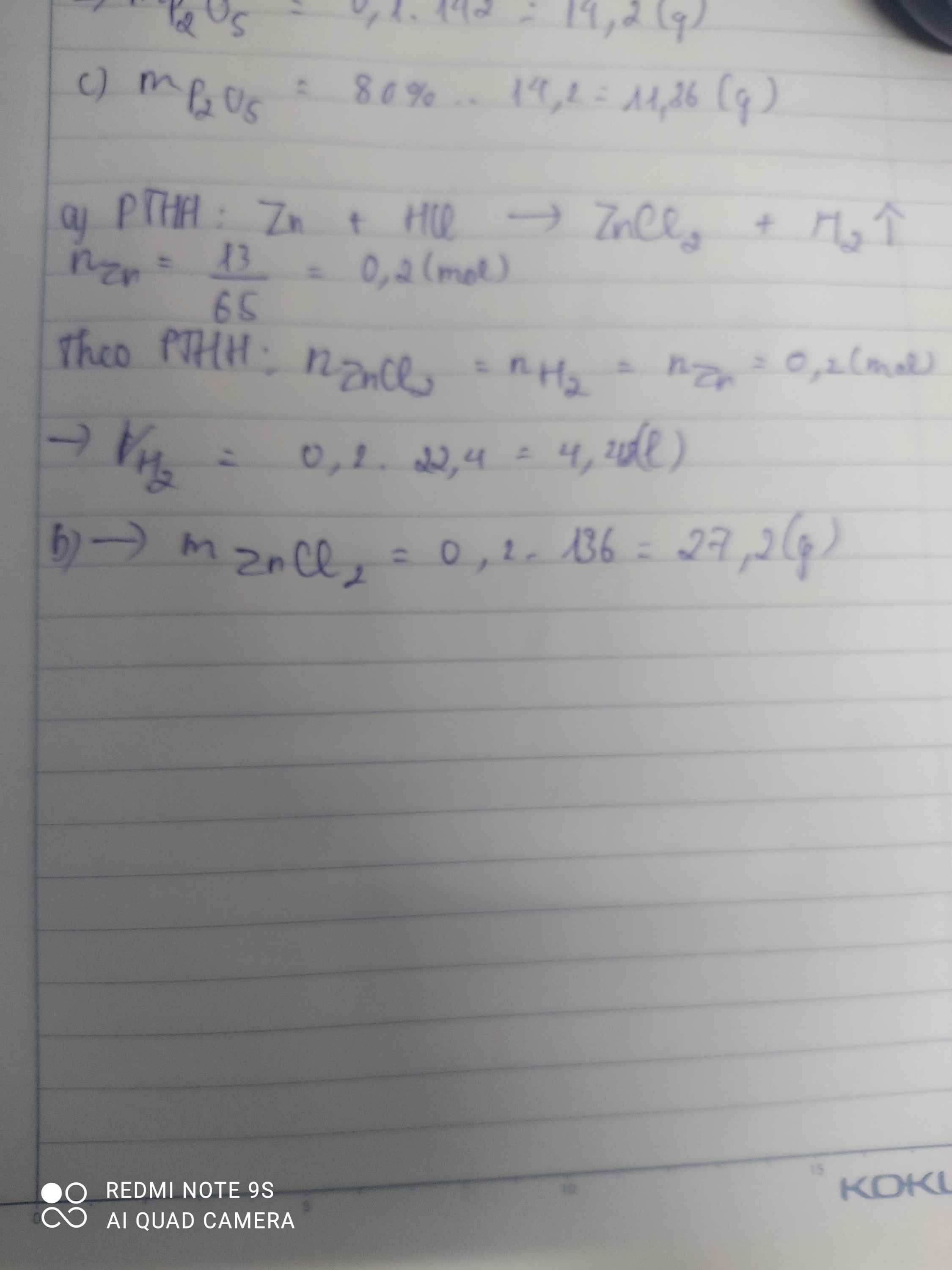
a) $n_{HCl} = \dfrac{18,25.50\%}{36,5} = 0,25(mol)$
$Zn + 2HCl \to ZnCl_2 + H_2$
Theo PTHH :
$n_{Zn\ pư} = n_{H_2} = \dfrac{1}{2}n_{HCl} = 0,125(mol)$
$m_{Zn\ pư} = 0,125.65 = 8,125(gam)$
$V_{H_2} = 0,125.22,4 = 2,8(lít)$
b)
$m_{dd\ sau\ pư} = 8,125 + 18,25 - 0,125.2 = 26,125(gam)$
$C\%_{ZnCl_2} = \dfrac{0,125.136}{26,125}.100\% = 65,1\%$