Trộn 10gam dung dịch Ba(NO3)2 26,1% và 10 gam dung dịch H2SO4 14,7% thì thu được kết tủa A và dung dịch C . Tính nồng độ phần trăm của HNO3 trong dung dịch C
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a, \(n_{HCl}=0,2.0,1=0,02\left(mol\right)=n_{H^+}=n_{Cl^-}\)
\(n_{H_2SO_4}=0,2.0,15=0,03\left(mol\right)=n_{SO_4^{2-}}\) \(\Rightarrow n_{H^+}=2n_{H_2SO_4}=0,06\left(mol\right)\)
\(\Rightarrow\Sigma n_{H^+}=0,02+0,06=0,08\left(mol\right)\)
\(n_{Ba\left(OH\right)_2}=0,3.0,05=0,015\left(mol\right)=n_{Ba^{2+}}\)
\(\Rightarrow n_{OH^-}=2n_{Ba\left(OH\right)_2}=0,03\left(mol\right)\)
\(H^++OH^-\rightarrow H_2O\)
0,03___0,03 (mol) ⇒ nH+ dư = 0,05 (mol)
\(Ba^{2+}+SO_4^{2-}\rightarrow BaSO_4\)
0,015___0,015______0,015 (mol) ⇒ nSO42- dư = 0,015 (mol)
⇒ m = mBaSO4 = 0,015.233 = 3,495 (g)
\(\left[Cl^-\right]=\dfrac{0,02}{0,2+0,3}=0,04\left(M\right)\)
\(\left[H^+\right]=\dfrac{0,05}{0,2+0,3}=0,1\left(M\right)\)
\(\left[SO_4^{2-}\right]=\dfrac{0,015}{0,2+0,3}=0,03\left(M\right)\)
b, pH = -log[H+] = 1

\(a,PTHH:H_2SO_4+BaCl_2\rightarrow BaSO_4\downarrow+2HCl\\ \left\{{}\begin{matrix}m_{H_2SO_4}=\dfrac{300\cdot9,8\%}{100\%}=29,4\left(g\right)\\m_{BaCl_2}=\dfrac{200\cdot26\%}{100\%}=52\left(g\right)\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}n_{H_2SO_4}=\dfrac{29,4}{98}=0,3\left(mol\right)\\n_{BaCl_2}=\dfrac{52}{208}=0,25\left(mol\right)\end{matrix}\right.\)
Vì \(\dfrac{n_{H_2SO_4}}{1}>\dfrac{n_{BaCl_2}}{1}\) nên H2SO4 dư
\(\Rightarrow n_{BaSO_4}=n_{BaCl_2}=0,25\left(mol\right)\\ \Rightarrow a=m_{BaSO_4}=0,25\cdot233=58,25\left(g\right)\\ b,n_{HCl}=n_{BaCl_2}=0,25\left(mol\right)\\ \Rightarrow m_{CT_{HCl}}=0,25\cdot36,5=9,125\left(g\right)\\ m_{dd_{HCl}}=300+200-58,25=441,75\left(g\right)\\ \Rightarrow C\%_{HCl}=\dfrac{9,125}{441,75}\cdot100\%\approx2,07\%\)

Gọi \(\left\{{}\begin{matrix}C_{M\left(A\right)}=aM\\C_{M\left(B\right)}=bM\end{matrix}\right.\)
Giả sử trộn 50ml dd A với 50ml dd B để thu được 100ml dd C
=> \(\left\{{}\begin{matrix}n_{NaOH}=0,05a\left(mol\right)\\n_{Ba\left(OH\right)_2}=0,05b\left(mol\right)\end{matrix}\right.\)
\(n_{BaSO_4}=\dfrac{9,32}{233}=0,04\left(mol\right)\)
nH2SO4 = 0,035.2 = 0,07 (mol)
PTHH: Ba(OH)2 + H2SO4 --> BaSO4 + 2H2O
0,04<----0,04<-------0,04
2NaOH + H2SO4 --> Na2SO4 + 2H2O
0,06<----0,03
=> \(\left\{{}\begin{matrix}0,05a=0,06\\0,05b=0,04\end{matrix}\right.\)
=> a = 1,2; b = 0,8
20 ml dd A chứa nNaOH = 0,02.1,2 = 0,024 (mol)
\(n_{Al_2O_3}=\dfrac{20,4}{102}=0,2\left(mol\right)\)
PTHH: 2NaOH + Al2O3 --> 2NaAlO2 + H2O
0,024-->0,012
Ba(OH)2 + Al2O3 --> Ba(AlO2)2 + H2O
0,188<---0,188
=> \(V_{dd.B}=\dfrac{0,188}{0,8}=0,235\left(l\right)=235\left(ml\right)\)

\(m_{Ba\left(OH\right)_2}=150.17,1\%=25,65\left(g\right)\Rightarrow n_{Ba\left(OH\right)_2}=\dfrac{25,65}{171}=0,15\left(mol\right)\)
\(m_{FeSO_4}=250.15,2\%=38\left(g\right)\Rightarrow n_{FeSO_4}=\dfrac{38}{152}=0,25\left(mol\right)\)
PTHH: Ba(OH)2 + FeSO4 → Fe(OH)2 + BaSO4
Mol: 0,15 0,15 0,15 0,15
Ta có: \(\dfrac{0,15}{1}< \dfrac{0,25}{1}\) ⇒ Ba(OH)2 pứ hết, FeSO4 dư
\(m=0,15.233=34,95\left(g\right)\)
\(C\%_{Fe\left(OH\right)_2}=\dfrac{0,15.90.100\%}{400}=3,375\%\)
\(C\%_{FeSO_4dư}=\dfrac{\left(0,25-0,15\right).152.100\%}{400}=3,8\%\)

a)b)c)d) mBaCl2=150.16,64%=24,96g
=>nBaCl2=0,12 mol
mH2SO4=100.14,7%=14,7g=>nH2SO4=0,15mol
BaCl2 + H2SO4 =>BaSO4 +2HCl
Bđ: 0,12 mol; 0,15 mol
Pứ: 0,12 mol=>0,12 mol=>0,12 mol=>0,24 mol
Dư: 0,03 mol
Dd ban đầu chứa BaCl2 0,12 mol và H2SO4 0,15 mol
Dd A sau phản ứng chứa HCl 0,24 mol và H2SO4 dư 0,03 mol
mHCl=0,24.36,5=8,76g
mH2SO4=0,03.98=2,94g
Kết tủa B là BaSO4 0,12 mol=>mBaSO4=0,12.233=27,96g
mddA=mddBaCl2+mddH2SO4-mBaSO4
=150+100-27,96=222,04g
C%dd HCl=8,76/222,04.100%=3,945%
C% dd H2SO4=2,94/222,04.100%=1,324%
e) HCl +NaOH =>NaCl +H2O
0,24 mol=>0,24 mol
H2SO4 +2NaOH =>Na2SO4 + 2H2O
0,03 mol=>0,06 mol
TÔNG nNaOH=0,3 mol
=>V dd NaOH=0,3/2=0,15 lit

Ta có nZn = nZnO = 0,1 mol, nHNO3 = 0,5 mol
Kết tủa thu được là Zn(OH)2: 0,06 mol
Vậy dung dịch sau phản ứng + KOH chứa K2ZnO2: (0,1 + 0,1 - 0,06) = 0,14 mol và KNO3: (0,74 - 2 × 0,14) = 0,46 mol
Bảo toàn nguyên tố N → nN (Y) + nNH4 + = 0,5 - 0,46 = 0,04 mol
Nếu khí Y chứa 1 nguyên tố N (NO và NO2) → nNH4+ = 0,04 - 0,015 = 0,025
Bảo toàn electron → số electron trao đổi của Y là: 0,1×2−0,025×80,015 = 0 (Vô lý)
Vậy khí Y chứa 2 nguyên tố N (N2, N2O) → nNH4+ = 0,04 - 0,015 × 2 = 0,01 mol
Bảo toàn electron → số electron trao đổi của Y là: 0,1×2−0,01×80,015 = 8 → khí tạo thành là N2O
Bảo toàn khối lượng → mdd = 14,6 + 250 - 0,015 × 44 = 263,94 gam
C% Zn(NO3)2 = (0,2×189/ 263,94 )×100% = 14,32%
Đáp án C

Chọn đáp án D
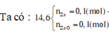


Có NH4NO3 vì nếu Y là N2 ![]()
Sau khi cho KOH vào thì K nó chạy đi đâu?Việc trả lời câu hỏi này sẽ giúp ta tiết kiệm rất nhiều thời gian và không cần quan tâm HNO3 thừa thiếu thế nào.
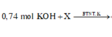

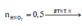
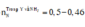
![]()
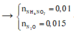
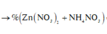
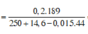
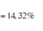

Ta có: \(m_{CuSO_4}=\dfrac{10\%.160}{100\%}=16\left(g\right)\)
=> \(n_{CuSO_4}=\dfrac{16}{160}=0,1\left(mol\right)\)
Ta lại có: \(m_{NaOH}=\dfrac{5\%.240}{100\%}=12\left(g\right)\)
=> \(n_{NaOH}=\dfrac{12}{40}=0,3\left(mol\right)\)
a. PTHH: \(CuSO_4+2NaOH--->Cu\left(OH\right)_2\downarrow+Na_2SO_4\)
Ta thấy: \(\dfrac{0,1}{1}< \dfrac{0,3}{2}\)
Vậy NaOH dư, CuSO4 hết.
Theo PT: \(n_{Cu\left(OH\right)_2}=n_{Na_2SO_4}=n_{CuSO_4}=0,1\left(mol\right)\)
=> \(m_{Cu\left(OH\right)_2}=0,1.98=9,8\left(g\right)\)
b. Ta có: \(m_{dd_{Na_2SO_4}}=240+16-9,8=246,2\left(g\right)\)
Ta có: \(m_{Na_2SO_4}=0,1.142=14,2\left(g\right)\)
=> \(C_{\%_{Na_2SO_4}}=\dfrac{14,2}{246,2}.100\%=5,77\%\)
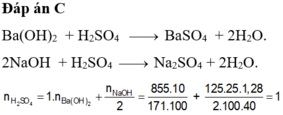
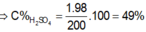
Ta có: \(\left\{{}\begin{matrix}n_{Ba\left(NO_3\right)_2}=\dfrac{26,1\%.10}{261}=0,01\left(mol\right)\\n_{H_2SO_4}=\dfrac{14,7\%.10}{98}=0,015\left(mol\right)\end{matrix}\right.\)
PTHH: \(Ba\left(NO_3\right)_2+H_2SO_4\rightarrow BaSO_4\downarrow+2HNO_3\)
ban đầu 0,01 0,015
phản ứng 0,01---------->0,01
sau phản ứng 0 0,005 0,01 0,02
`=>` \(m_{ddspư}=10+10-0,01.233=17,67\left(g\right)\)
`=>` \(C\%_{HNO_3}=\dfrac{0,02.63}{17,67}.100\%=7,13\%\)
\(Ba\left(NO_3\right)_2+H_2SO_4->BaSO_4+2HNO_3\)
\(n_{Ba\left(NO_3\right)_2}=\dfrac{10.26,1\%}{261}=0,01mol;n_{H_2SO_4}=\dfrac{10.14,7\%}{98}=0,015mol\)
Lập tỷ lệ \(\dfrac{n_{Ba\left(NO_3\right)_2}}{1}< \dfrac{n_{H_2SO_4}}{1}\) => Ba(NO3)2 hết
\(m_{BaSO_4}=233.0,01=2,33g\)
\(m_{HNO_3}=0,01.2.63=1,26g\)
=> \(C\%_{HNO_3}=\dfrac{1,26}{10+10-2,33}.100\%=7,13\%\)