Tính khối lượng quặng pirit Fe ( chứa 60% FeS2) cần lấy để sản xuất được 5 tấn H2SO4 biết hiệu suất của quá trình sản xuất đạt 75%.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(m_{H_2SO_4}=\dfrac{1000000.98\%}{100\%}=980000(g)\\ \Rightarrow n_{H_2SO_4}=\dfrac{980000}{98}=10000(mol)\\ \Rightarrow n_{FeS_2}=\dfrac{1}{2}n_{H_2SO_4}.80\%=4000(mol)\\ \Rightarrow m_{FeS_2}=4000.120=480000(g)\)

\(n_{Fe} = \dfrac{5000.1000}{56} = \dfrac{625000}{7}\ kmol\\ n_{FeS_2\ đã\ dùng} = \dfrac{n_{Fe}}{H\%} = \dfrac{\dfrac{625000}{7}}{89,6\%} = 99649,23\ kmol\\ m_{quăng\ pirit} = \dfrac{m_{FeS_2}}{90\%} = \dfrac{99649,23.120}{90\%} = 13259897,33 (kg) = 13259,89(tấn)\)
\(n_{Fe}=\dfrac{5000\cdot10^6}{56}=\dfrac{625}{7}\cdot10^6\left(mol\right)\)
\(BTFe:\)
\(n_{FeS_2}=n_{Fe}=\dfrac{625}{7}\cdot10^6\left(mol\right)\)
\(n_{FeS_2\left(tt\right)}=\dfrac{\dfrac{625}{7}\cdot10^6}{89.6}=\dfrac{56000\cdot10^6}{7}\left(mol\right)\)
\(\Rightarrow m_{FeS_2}=\dfrac{56000\cdot10^6\cdot120}{7}=960000\cdot10^6\left(g\right)=960000\left(tấn\right)\)
\(m_{quặng}=\dfrac{960000\cdot100}{90}=1066666.67\left(tấn\right)\)

Đáp án C
FeS2 → Fe → thép không gỉ.
Khối lượng quặng thực tế: 12 . 0 , 74 . 120 56 . 0 , 6 . 0 , 8 = 3 , 7 ( tấn )

\(TQ:FeS_2->2SO_2->2SO_3->2H_2SO_4\\ m_{FeS_2}=\dfrac{1\cdot120}{98\cdot2\cdot0,7}=0,8746\left(\text{tấn }\right)\)

Đáp án C.
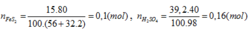
FeS2→ 2H2SO4
0,08 ← 0,16 (mol)
H% = 0,08.100/0,1= 80%


Ta có: \(m_{H_2SO_4\left(TT\right)}=5\left(tấn\right)\)
Mà `H = 75\%`
=> \(m_{H_2SO_4\left(LT\right)}=\dfrac{5}{75\%}=\dfrac{20}{3}\left(tấn\right)=\dfrac{20000}{3}\left(kg\right)\)
=> \(n_{H_2SO_4\left(LT\right)}=\dfrac{20000}{3.98}=\dfrac{10000}{147}\left(kmol\right)\)
BTNT S: \(n_{FeS_2}=\dfrac{1}{2}n_{H_2SO_4}=\dfrac{5000}{147}\left(kmol\right)\)
=> \(m_{quặng}=\dfrac{\dfrac{5000}{147}.120}{60\%}=6802,72\left(kg\right)\)