Câu 616. Theo quy tắc octet (bát tử): Trong quá trình hình thành liên kết hóa học, nguyên tử các nguyên tố nhóm Á có xu hướng tạo thành lớp vỏ ngoài cùng có
A. 8 electron tương ứng với khí hiểm gần nhất.
B. & electron tương ứng với khi hiếm gần nhất ( hoặc 2 electron tương ứng với khí hiểm
Helium.).
C. 2 electron tương ứng với kim loại gần nhất.
D. 6 electron tương ứng với phi kim gần nhất.
Câu 617. Nguyên tử nguyên tố nào sau đây có xu hướng đạt cấu hình electron bền vững của khi hiếm argon khi tham gia hình thành liên kết hóa học
A. Fluorine.
B. Oxygen.
C. Hydrogen.
D. Chlorine.
Câu 618: Liên kết ion là liên kết được tạo thành
A. bởi lực hút tĩnh điện giữa các ion mang điện tích trái dấu.
B. bởi cặp electron chung giữa 1 nguyên tử kim loại và 1 nguyên tử phi kim.
C. bởi cặp electron chung giữa 2 nguyên tử phi kim điển hình.
D. bởi cặp electron chung giữa 2 nguyên tử kim loại.
Câu 619: Liên kết ion thường được tạo thành giữa
A. kim loại điển hình (Na, K...) và phi kim điển hình (F, Cl, O...).
B. kim loại và phi kim bất kỳ.
C. hai phi kim có chênh lệch độ âm điện không đáng
kể.
D. hai phi kim có chênh lệch độ âm điện tương đối (1,7 > Ax>0,4
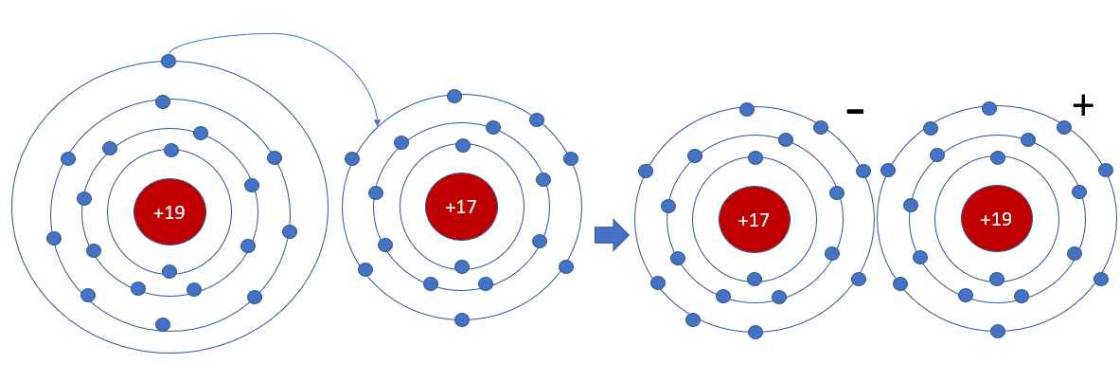
Câu 620: Liên kết ion trong KC1 là do
A.kali và clo chung 1 electron tạo thành cặp electron chung lệch về phía kali
B. kali và cho góp chung 1 electron tạo thành cặp electron chung lệch về phía cho.
C. nguyên tử kali có nhường electron tạo anion, nguyên tử clo nhận electron tạo cation.
D. nguyên tử kali có nhường electron tạo cation, nguyên tử clo nhận electron tạo anion.
Câu 621: Bản chất liên kết trong phân tử NaCl là
A. liên kết ion.
B. liên kết cộng hóa trị có cực.
C. liên kết cộng hóa trị không cực.
D. liên kết phối trí (cho nhận).
Câu 622: Chất nào dưới đây có liên kết ion :
A. Cl₂
B. HCI
C. NaF
D. O₂
Câu 623: Dãy các chất đều chứa liên kết ion là:
B. Na O, MgO, HCI
D. O2, NaCl, KCI
A. Cl₂, NaCl, H₂O
C. NaF, KCI, KO


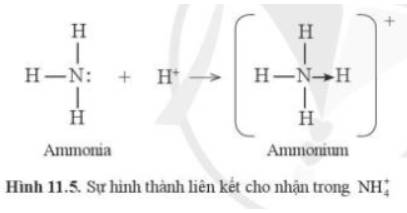
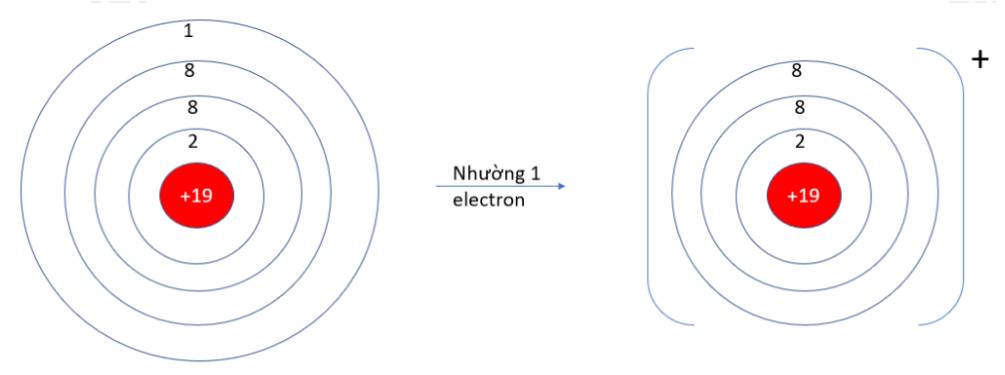

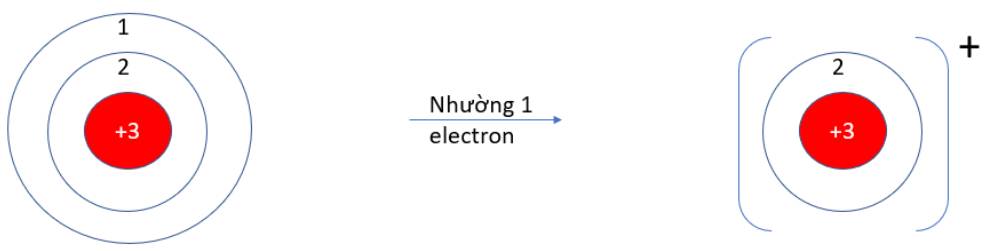
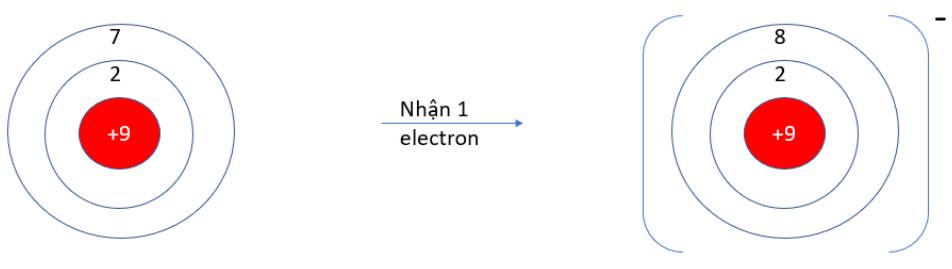
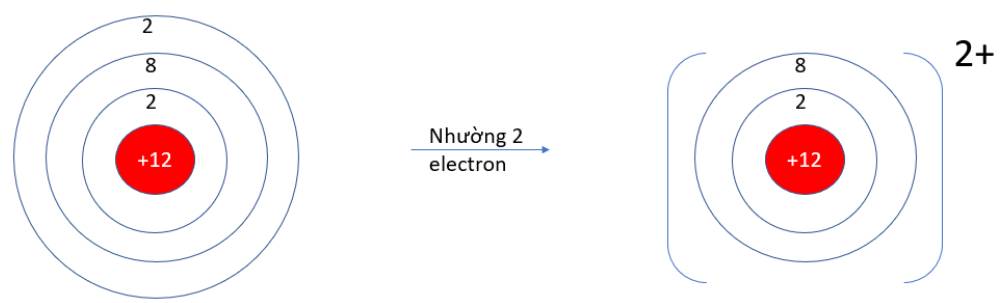
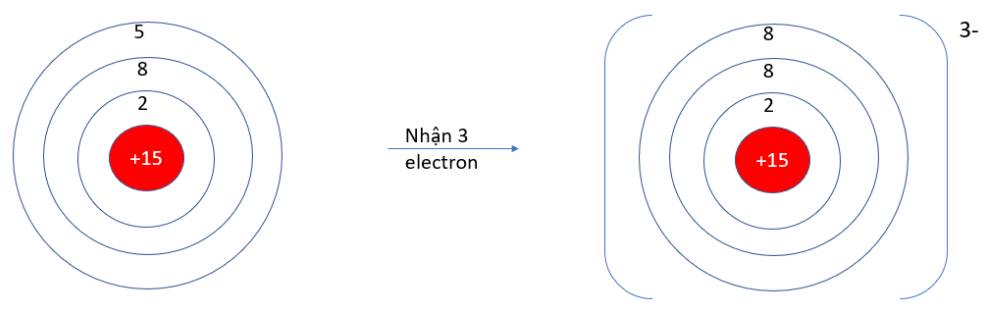
9.10:
a: \(1s^22s^22p^4\)
nhận 2e lên \(1s^22s^22p^6\)
b: \(1s^22s^22p^63s^23p^64s^2\) nhường 2e thành \(1s^22s^22p^63s^23p^6\)