9.1. Nguyên tử oxygen (Z =8) có xu hướng nhường hay nhận bao nhiêu electron để đạt được lớp vỏ thỏa mãn quy tắc octet?
A. Nhường 6 electron. B. Nhận 2 electron.
C. Nhường 8 electron. D. Nhận 6 electron.
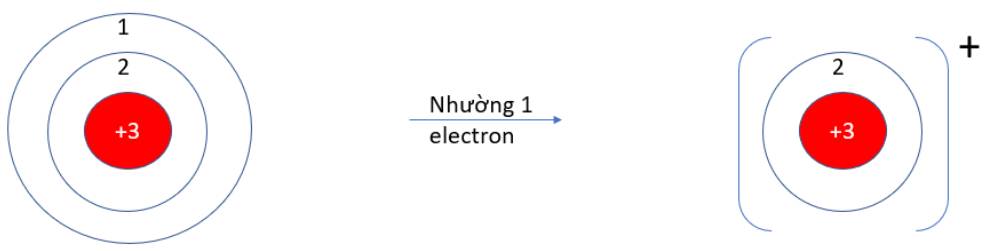
9.2. Nguyên tử Lithium (Z =3) có xu hướng nhường hay nhận bao nhiêu electron để đạt được lớp vỏ thỏa mãn quy tắc octet?
A. Nhường 1 electron. B. Nhận 7 electron.
C. Nhường 3 electron. D. Nhận 1 electron.
9.3. Nguyên tử nào dưới đây có thể nhường hoặc nhận 4 electron để đạt cấu hình bền vững?
A. Silicon. B. Beryllium.
C. Nitrogen. D. Selenium.
9.4. Nguyên tử nào dưới đây không có xu hướng nhường hoặc nhận electron để đạt được lớp vỏ thỏa mãn quy tắc octet?
A. Sodium. B. oxygen. C. Nitrogen. D. Neon.

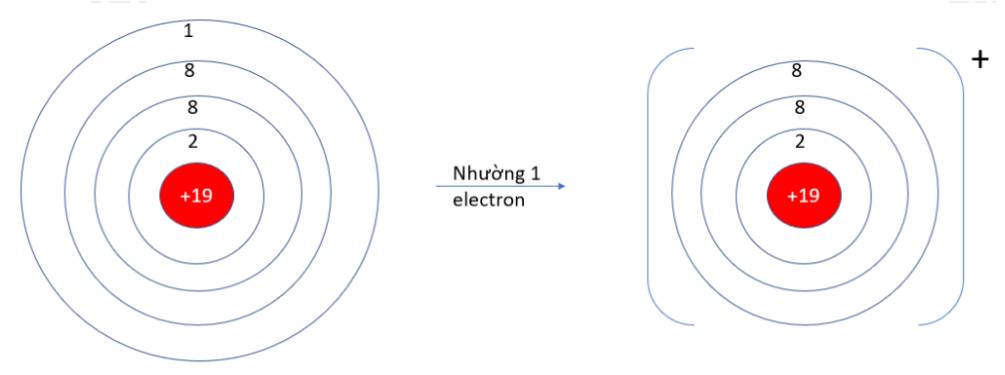

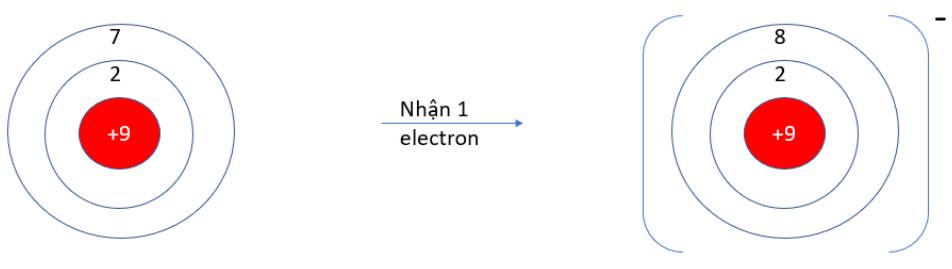
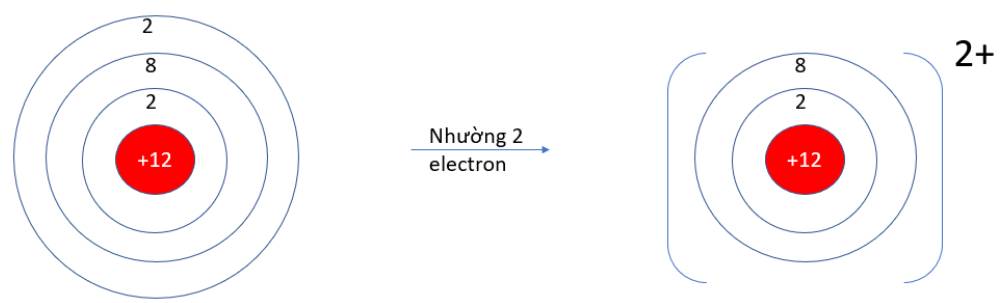
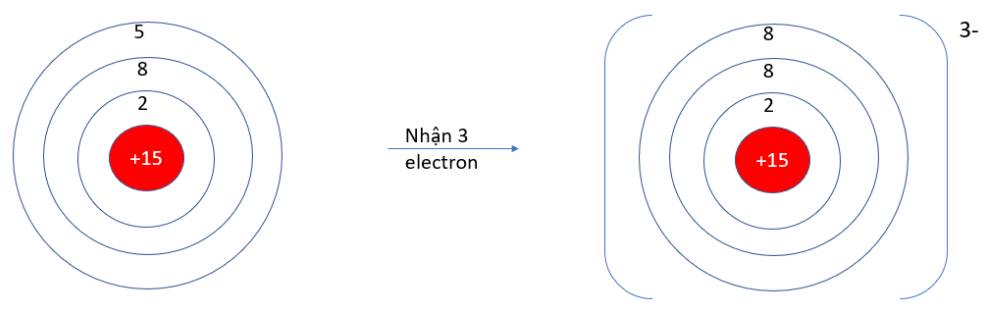

9.1 B
9.2: A
9.4: D