Dung dịch A có chứa 5% NaCl. Cần phải pha thêm bao nhiêu gam NaCl vào 50g để được dung dịch NaCl 10%? giúp t với (◍•ᴗ•◍)
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(a.\\ m_{KOH\left(A\right)}=150\cdot5\%=7,5g\\ m_{ddKOH12\%}=a\left(g\right)\\ \Rightarrow:\dfrac{7,5+12\%\cdot a}{a+150}=\dfrac{10}{100}\\ a=375\left(g\right)\)
\(b.\\ m_{NaCl\left(40^0C\right)}=1800\cdot30\%=540\left(g\right)\\ m_{H_2O\left(40^0C\right)}=1800-540=1260\left(g\right)\\ S_{20^0C}=\dfrac{540-m_{NaCl\left(kt\right)}}{1260-m_{NaCl\left(KT\right)}}=\dfrac{36}{100}\\ m_{NaCl\left(KT\right)}=135\left(g\right)\)

Gọi: a, b lần lượt là khối lượng dung dịch NaCl (4%) và NaCl (12%)
Ta có :
\(m_{dd_{NaCl\left(10\%\right)}}=a+b=100\left(g\right)\left(1\right)\)
\(m_{NaCl\left(10\%\right)}=100\cdot10\%=10\left(g\right)\)
\(m_{NaCl\left(4\%\right)}=0.04a\left(g\right)\)
\(m_{NaCl\left(12\%\right)}=0.12b\left(g\right)\)
\(\Rightarrow0.04a+0.12b=10\left(2\right)\)
\(\left(1\right),\left(2\right):a=25,b=75\)

1)
m NaCl = 200.15% = 30(gam)
m H2O = 200 -30 = 170(gam)
- Pha chế : Cân lấy 30 gam NaCl cho vào cốc. Đong lấy 170 gam nước cho vào cốc khuấy đều
2) n Na2O = a(mol)
m NaOH = 400.15% = 40(gam)
Na2O + H2O → 2NaOH
a...............a............2a..........(mol)
Sau pư :
m dd = 400 + 62a - 18a = 400 + 44a(gam)
m NaOH = 2a.40 + 40 = 80a + 40(gam)
=> C% NaOH = (80a + 40) / (400 + 44a) .100% = 25%
=> a = 20/23
=> m Na2O = 62. 20/23 = 53,91 gam

\(n_{NaCl\left(bđ\right)}=3,65\%.100=3,65\left(g\right)\)
\(\rightarrow m_{NaCl\left(sau.khi.pha\right)}=a+36,5\left(g\right)\\ m_{dd\left(sau.khi.pha\right)}=100+a\left(g\right)\\ \rightarrow C\%_{NaCl\left(7,3\%\right)}=\dfrac{a+3,65}{a+100}=7,3\%\\ \Leftrightarrow a=4\left(g\right)\)

Câu 5:
\(Đặt:V_{H_2O}=a\left(l\right)\left(a>0\right)\\ n_{KOH}=160.2,4=384\left(mol\right)\\ Vì:C_{MddKOH\left(cuối\right)}=2\left(M\right)\\ \Leftrightarrow\dfrac{384}{160+a}=2\\ \Leftrightarrow a=32\left(lít\right)\)
Vậy cần thêm 32 lít H2O

\(2Al_2O_3 \xrightarrow{đp} 4Al + 3O_2\\ m_{Al} = 4000(kg)\\ n_{Al} = \dfrac{4000}{27}(kmol)\\ \Rightarrow n_{Al_2O_3\ pư} = \dfrac{1}{2}n_{Al} = \dfrac{2000}{27}(kmol)\\ \Rightarrow m_{Al_2O_3\ đã\ dùng} = (\dfrac{2000}{27}.102) : 90\% = \dfrac{680 000}{81}(kg)\\ \Rightarrow m_{quặng} = \dfrac{680 000}{81} : 40\% = 20987(kg) ≃21(tấn)\)
Đáp án A

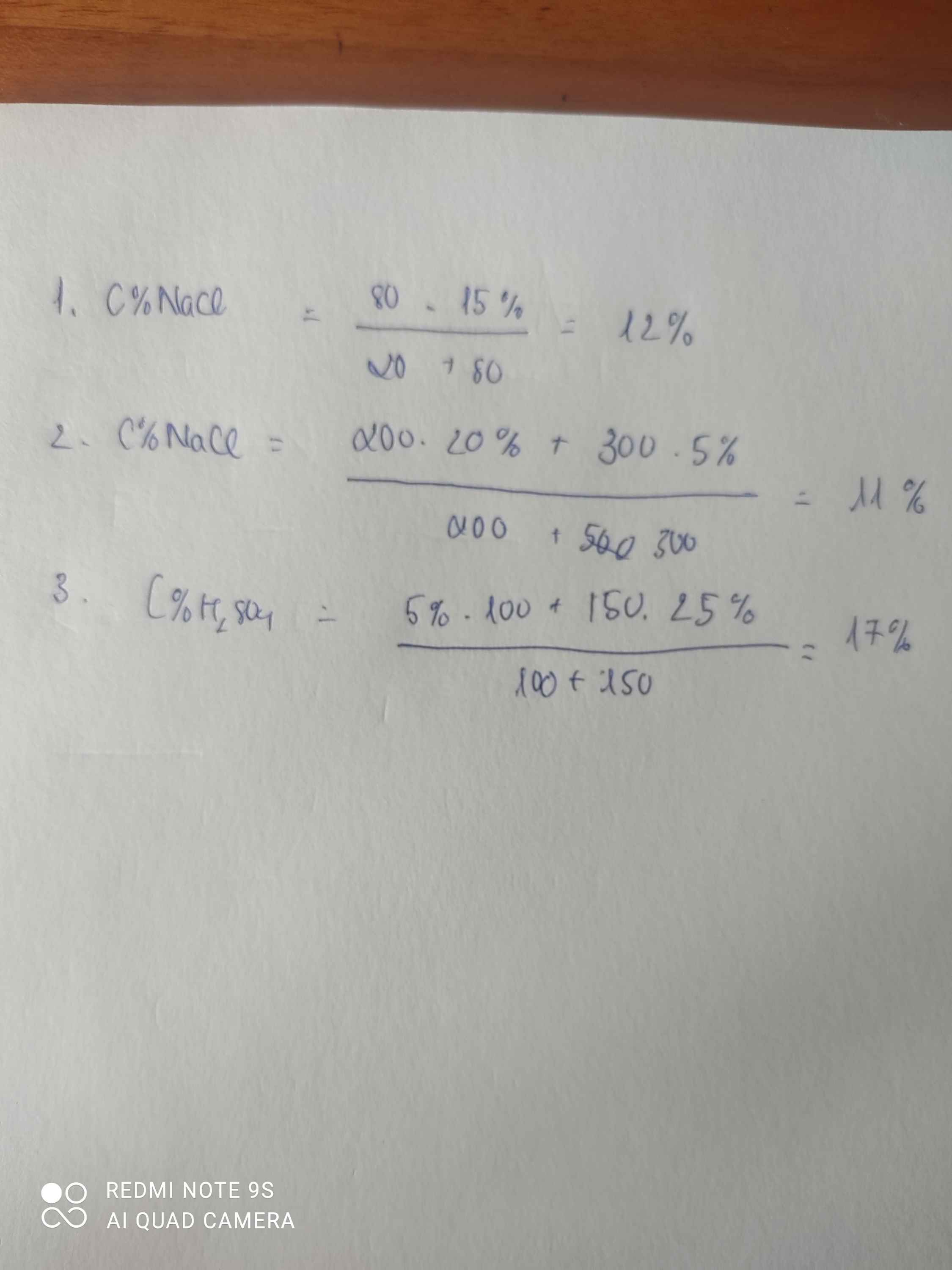
Số gam NaCl cần pha thêm :
\(m=\dfrac{50.10}{100}-\dfrac{5.10}{100}=4,5\left(g\right)\)