4/ cho Na vào nước để tạo 200g dd NaOH 20% .Hãy tính khối lượng của Na và thể tích khí H2 thoát ra.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(m_{NaOH}=200.10\%=20\left(g\right)\Rightarrow n_{NaOH}=\dfrac{20}{40}=0,5\left(mol\right)\)
PTHH: 2Na + 2H2O → 2NaOH + H2
Mol: 0,5 0,5 0,5
\(m_{Na}=0,5.23=11,5\left(g\right)\)
\(V_{H_2}=0,25.22,4=5,6\left(l\right)\)

\(n_{Na}=\dfrac{9,2}{23}=0,4\left(mol\right)\)
\(pthh:2Na+2H_2O->2NaOH+H_2\)
0,4 0,4 0,2
=> \(V_{H_2}=0,2.22,4=4,48\left(L\right)\\ m_{NaOH}=0,4.40=16\left(G\right)\)

nNa = 9.2/23 = 0.4 (mol)
2Na + 2H2O => 2NaOH + H2
0.4.........................0.4.......0.2
VH2 = 0.2 * 22.4 = 4.48 (l)
mNaOH = 0.4 * 40 = 16 (g)
mdd = 9.2 + 100 - 0.2 * 2 = 108.8 (g)
C% NaOH = 16 / 108.8 * 100% = 14.71%
PTHH: \(Na+H_2O\rightarrow NaOH+\dfrac{1}{2}H_2\uparrow\)
Ta có: \(n_{Na}=\dfrac{9,2}{23}=0,4\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}n_{NaOH}=0,4\left(mol\right)\\n_{H_2}=0,2\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}m_{NaOH}=0,4\cdot40=16\left(g\right)\\V_{H_2}=0,2\cdot22,4=4,48\left(l\right)\\m_{H_2}=0,2\cdot2=0,4\left(g\right)\end{matrix}\right.\)
Mặt khác: \(m_{dd\left(saup/ứ\right)}=m_{Na}+m_{H_2O}-m_{H_2}=108,8\left(g\right)\)
\(\Rightarrow C\%_{NaOH}=\dfrac{16}{108,8}\cdot100\%\approx14,71\%\)

\(a.2Na+2H_2O\rightarrow2NaOH+H_2\\ b.n_{Na}=\dfrac{9,2}{23}=0,4\left(mol\right)\\ n_{H_2}=\dfrac{1}{2}n_{Na}=0,2\left(mol\right)\\ \Rightarrow V_{H_2}=0,2.22,4=4,48\left(l\right)\\ n_{NaOH}=n_{Na}=0,4\left(mol\right)\\ \Rightarrow m_{NaOH}=0,4.40=16\left(g\right)\\ c.H_2+CuO-^{t^o}\rightarrow Cu+H_2O\\ n_{CuO}=\dfrac{12}{80}=0,15\left(mol\right)\\ LTL:\dfrac{0,2}{1}>\dfrac{0,15}{1}\Rightarrow H_2dưsauphảnứng\\ n_{H_2\left(pứ\right)}=n_{CuO}=0,15\left(mol\right)\\ \Rightarrow n_{H_2\left(dư\right)}=0,2-0,15=0,05\left(mol\right)\\ \Rightarrow m_{H_2\left(Dư\right)}=0,05.2=0,1\left(g\right)\)

\(n_{Na}=0.02\left(mol\right)\)
\(Na+H_2O\rightarrow NaOH+\dfrac{1}{2}H_2\)
\(0.02....................0.02........0.01\)
\(V_{H_2}=0.01\cdot22.4=0.224\left(l\right)\)
\(m_{NaOH}=0.02\cdot40=0.8\left(g\right)\)
\(C\%_{NaOH}=\dfrac{0.8}{0.46+200-0.01\cdot2}\cdot100\%=0.4\%\)

\(2Na+2H_2O\rightarrow2NaOH+H_2\\ n_{Na}=\dfrac{4,6}{23}=0,2\left(mol\right)\\ n_{H_2O}=\dfrac{1,8}{18}=0,1\left(mol\right)\\ LTL:\dfrac{0,2}{2}>\dfrac{0,1}{2}\\ \Rightarrow Nadư\\ n_{Na\left(pứ\right)}=n_{H_2O}=0,1\left(mol\right)\\ n_{Na\left(dư\right)}=0,2-0,1=0,1\left(mol\right)\\ \Rightarrow m_{Na}=0,1.23=2,3\left(g\right)\\ n_{H_2}=\dfrac{1}{2}n_{H_2O}=0,05\left(mol\right)\\ \Rightarrow V_{H_2}=0,05.22,4=1,12\left(l\right)\)

Ta thấy 1,75 lít > 1 lít
Chứng tỏ phần tác dụng với nước thì n Na = n NaOH không tác dụng hết n Al, còn phần sau là mới tác dụng hết
Na + H2O --> NaOH + 1/2.H2
x ---- ------ --------> x -----> x/2
Al + NaOH + H2O --> NaAlO2 + 3/2.H2
x <-----x ------------ ------- ------- ------- -> 3x/2
=> x/2 + 3x/2 = 1 <=> x = 0.5
Ta tính số mol do Al sinh ra là = 1.75 - 0.5/2 = 1,5 mol
Al + NaOH + H2O --> NaAlO2 + 3/2.H2
1 <---------- --------- ---------- ----------- 1,5 mol
% m Al = ( 1.27 ) / (1.27 + 0.5.23 ) x 100% = 70,13%
=> %Na = 29,87%
=> Đáp án B

Đáp án D
Do các khí đo ở cùng điều kiện nên ta “có thể” coi V như số mol để tính cho đơn giản.
TH1:
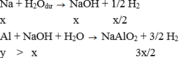
TH2:
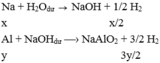
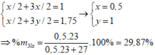

\(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\\
pthh:Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,1 0,2 0,1 0,1
\(m_{HCl}=0,2.36,5=7,3\left(g\right)\\
V_{H_2}=0,1.22,4=2,24l\\
m_{\text{dd}}=6,5+200-\left(0,1.2\right)=206,3g\)
bài 2 :
\(n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\\
pthh:Mg+2HCl\rightarrow MgCl_2+H_2\)
0,2 0,4 0,2 0,2
\(m_{HCl}=0,4.36,5=14,6g\\
V_{H_2}=0,2.22,4=4,48l\\
m\text{dd}=4,8+200-0,4=204,4g\\
C\%=\dfrac{0,2.136}{204,4}.100\%=13,3\%\)
\(m_{NaOH}=200.20\%=40\left(g\right)\Rightarrow n_{NaOH}=\dfrac{40}{40}=1\left(mol\right)\)
2Na + 2H2O ----> 2NaOH + H2
1 1 0,5
\(m_{Na}=1.23=23\left(g\right)\)
\(V_{H_2}=0,5.22,4=11,2\left(l\right)\)