MN giúp mik vs ạ mik đang cần để ôn thi
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


#)Giải :
Vai trò của vành đai mặt trời :
- Vành đai Mặt trời (Sun Belt) là khu vực băng ngang miền Tây và Tây Nam nước Mỹ. Trong vài thập kỷ qua, khu vực Vành đai Mặt trời chứng kiến sự phát triển về ... cử của Hoa Kỳ đều xuất thân từ các tiểu bang thuộc Vành đai Mặt trời (ngoại trừ Gerald Ford )
#~Will~be~Pens~#
Vành đai Mặt Trời” là vùng công nghiệp mới của Hoa Kì tập trung ở phía Nam, Tây Nam và Đông Bắc.
Tác động của cuộc cách mạng KH-KT và toàn cầu hoá nền kinh tế thế giới đã làm xuất hiện ngành công nghiệp hiện đại gắn liền với việc hình thành các trung tâm công nghiệp và nghiên cứu khoa học ở phía nam và tây Hoa Kỳ làm xuất hiện “Vành đai Mặt Trời”
~ Học tốt ~ K cho mk nhé! Thank you

tia tới SI
tia phản xạ IR
Theo định luật phản xạ thì góc tới bằng góc phản xạ
⇒ ^SIN=60:2=30 độ
⇒ Góc tới bằng 30 độ

5: \(=\dfrac{1}{2}\cdot10-\dfrac{1}{2}=\dfrac{1}{2}\cdot9=\dfrac{9}{2}\)

a. f(\(\dfrac{-1}{2}\)) = \(4.\left(\dfrac{-1}{2}\right)^2+3.\left(\dfrac{-1}{2}\right)-2\)
= \(4.\dfrac{1}{4}-\left(\dfrac{-3}{2}\right)-\dfrac{4}{2}\)
= \(\dfrac{2}{2}+\dfrac{3}{2}-\dfrac{4}{2}\)
= \(\dfrac{1}{2}\)


a)
- Cho các khí tác dụng với giấy quỳ tím ẩm
+ Ban đầu QT chuyển đỏ, sau đó mất màu: Cl2
\(Cl_2+H_2O⇌HCl+HClO\)
+ Không hiện tượng: O2, O3 (1)
- Dẫn khí ở (1) qua dd KI/hồ tinh bột:
+ Không hiện tượng: O2
+ dd chuyển màu xanh: O3
O3 + 2KI + H2O --> 2KOH + I2 + O2 (I2 làm xanh hồ tinh bột)
b)
- Cho các khí tác dụng với giấy quỳ tím ẩm:
+ QT chuyển đỏ: CO2
\(CO_2+H_2O⇌H_2CO_3\)
+ Không hiện tượng: O2, N2, O3 (1)
- Dẫn khí ở (1) qua dd KI/hồ tinh bột:
+ Không hiện tượng: O2, N2 (2)
+ dd chuyển màu xanh: O3
O3 + 2KI + H2O --> 2KOH + I2 + O2 (I2 làm xanh hồ tinh bột)
- Cho que đóm còn tàn đỏ tác dụng với khí ở (2):
+ Que đóm bùng cháy: O2
+ Que đóm tắt: N2
c)
- Dẫn các khí qua dd Br2 dư:
+ dd nhạt màu dần: SO2, H2S (1)
SO2 + Br2 + 2H2O --> H2SO4 + 2HBr
H2S + 4Br2 + 4H2O --> H2SO4 + 8HBr
+ Không hiện tượng: CO2
- Dẫn khí ở (1) qua dd Ca(OH)2
+ Kết tủa trắng: SO2
Ca(OH)2 + SO2 --> CaSO3 + H2O
+ Không hiện tượng: H2S

Câu 10:
\(n_{H_2}=\dfrac{1,12}{22,4}=0,05\left(mol\right)\)
PTHH: Mg + H2SO4 --> MgSO4 + H2
0,05<--0,05<------------0,05
MgO + H2SO4 --> MgSO4 + H2O
0,15<--0,15
=> m = 0,05.24 + 0,15.40 = 7,2 (g)
Câu 11:
a) \(n_{Fe}=\dfrac{2,8}{56}=0,05\left(mol\right)\)
PTHH: 2Fe + 6H2SO4 --> Fe2(SO4)3 + 3SO2 + 6H2O
0,05-------------------------->0,075
=> VSO2 = 0,075.22,4 = 1,68 (l)
b) \(n_{Cu}=\dfrac{3,2}{64}=0,05\left(mol\right)\)
PTHH: Cu + 2H2SO4 --> CuSO4 + SO2 + 2H2O
0,05------------------------>0,05
=> VSO2 = 0,05.22,4 = 1,12 (l)

Câu 14:
a)
Bảo toàn H: \(n_{H_2SO_4\left(pư\right)}=n_{H_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
Theo ĐLBTKL: mrắn trc pư + mH2SO4 = mrắn sau pư + mH2
=> m + 0,4.98 = 53,81 + 0,4.2
=> m = 15,41 (g)
b)
Gọi công thức chung của Al, Mg, Zn là R (hóa trị n), có số mol = a (mol)
Gọi số mol Fe là b (mol)
PTHH: 2R + nH2SO4 --> R2(SO4)n + nH2
a-------------------------->0,5an
Fe + H2SO4 --> FeSO4 + H2
b--------------------->b
=> 0,5an + b = 0,4 (1)
\(n_{SO_2}=\dfrac{10,304}{22,4}=0,46\left(mol\right)\)
PTHH: 2R + 2nH2SO4 --> R2(SO4)n + nSO2 + 2nH2O
a--------------------------->0,5an
2Fe + 6H2SO4 --> Fe2(SO4)3 + 3SO2 + 6H2O
b----------------------------->1,5b
=> 0,5an + 1,5b = 0,46 (2)
(1)(2) => b = 0,12 (mol)
=> \(\%Fe=\dfrac{0,12.56}{15,41}.100\%=43,61\%\)
Câu 15:
Gọi số mol Fe, O2(pư) là a, b (mol)
=> 56a + 32b = 8,64 (1)
\(n_{SO_2}=\dfrac{1,008}{22,4}=0,045\left(mol\right)\)
Fe0 - 3e --> Fe+3
a--->3a
O20 + 4e --> 2O-2
b--->4b
S+6 + 2e --> S+4
0,09<--0,045
Bảo toàn e: 3a - 4b = 0,09 (2)
(1)(2) => a = 0,117 (mol); b = 0,06526 (mol)
=> m = 0,117.56 = 6,552 (g)

a)
- Cho các dd tác dụng với dd HCl dư
+ Sủi bọt khí: Na2SO3
Na2SO3 + 2HCl --> 2NaCl + SO2 + H2O
+ Không hiện tượng: NaCl, Na2SO4, NaNO3 (1)
- Cho dd ở (1) tác dụng với dd BaCl2
+ Kết tủa trắng: Na2SO4
Na2SO4 + BaCl2 --> 2NaCl + BaSO4\(\downarrow\)
+ Không hiện tượng: NaCl, NaNO3 (2)
- Cho dd ở (2) tác dụng với dd AgNO3:
+ Không hiện tượng: NaNO3
+ Kết tủa trắng: NaCl
\(NaCl+AgNO_3\rightarrow NaNO_3+AgCl\downarrow\)
b)
- Cho các dd tác dụng với dd Ba(NO3)2
+ Không hiện tượng: HCl, HNO3 (1)
+ Kết tủa trắng: H2SO4(đ), H2SO4(l) (2)
- Cho dd ở (1) tác dụng với dd AgNO3:
+ Không hiện tượng: HNO3
+ Kết tủa trắng: HCl
\(AgNO_3+HCl\rightarrow AgCl\downarrow+HNO_3\)
- Cho Cu tác dụng với dd ở (2)
+ Không hiện tượng: H2SO4(l)
+ Chất rắn tan, dd có màu xanh: H2SO4(đ)
Cu + 2H2SO4 --> CuSO4 + SO2 + 2H2O
c)
- Cho các dd tác dụng với dd BaCl2
+ Không hiện tượng: NaOH
+ Kết tủa trắng: H2SO4, Fe2(SO4)3, CuSO4 (1)
\(BaCl_2+H_2SO_4\rightarrow BaSO_4\downarrow+2HCl\)
\(Fe_2\left(SO_4\right)_3+3BaCl_2\rightarrow2FeCl_3+3BaSO_4\downarrow\)
\(CuSO_4+BaCl_2\rightarrow BaSO_4\downarrow+CuCl_2\)
- Cho dd ở (1) tác dụng với dd NaOH
+ Không hiện tượng: H2SO4
2NaOH + H2SO4 --> Na2SO4 + 2H2O
+ Kết tủa nâu đỏ: Fe2(SO4)3
\(Fe_2\left(SO_4\right)_3+6NaOH\rightarrow2Fe\left(OH\right)_3\downarrow+3Na_2SO_4\)
+ Kết tủa xanh: CuSO4
\(CuSO_4+2NaOH\rightarrow Cu\left(OH\right)_2\downarrow+Na_2SO_4\)
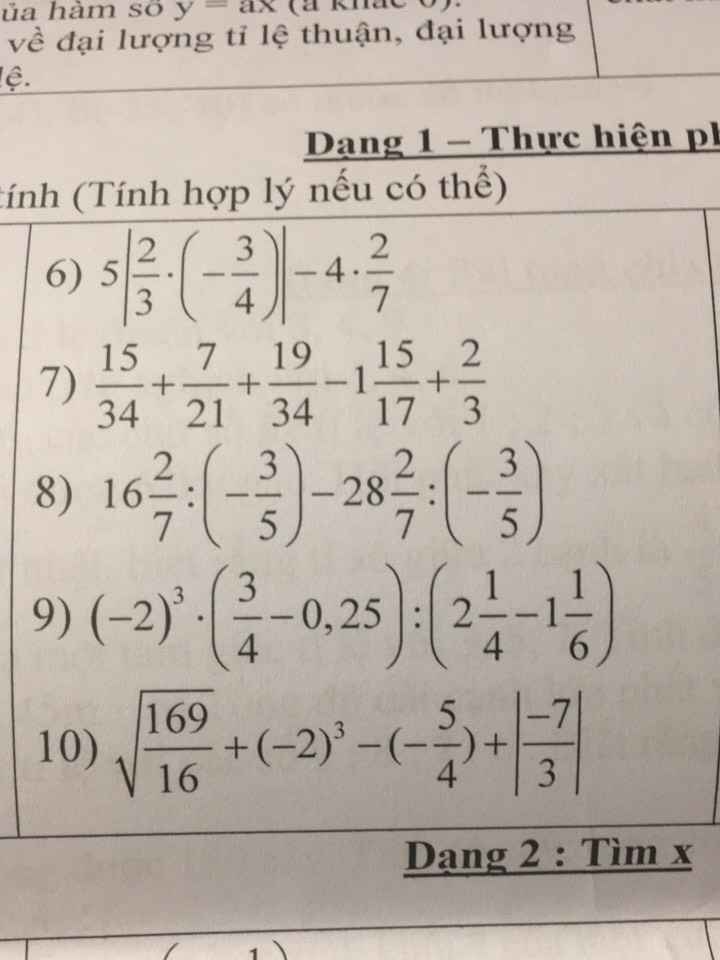
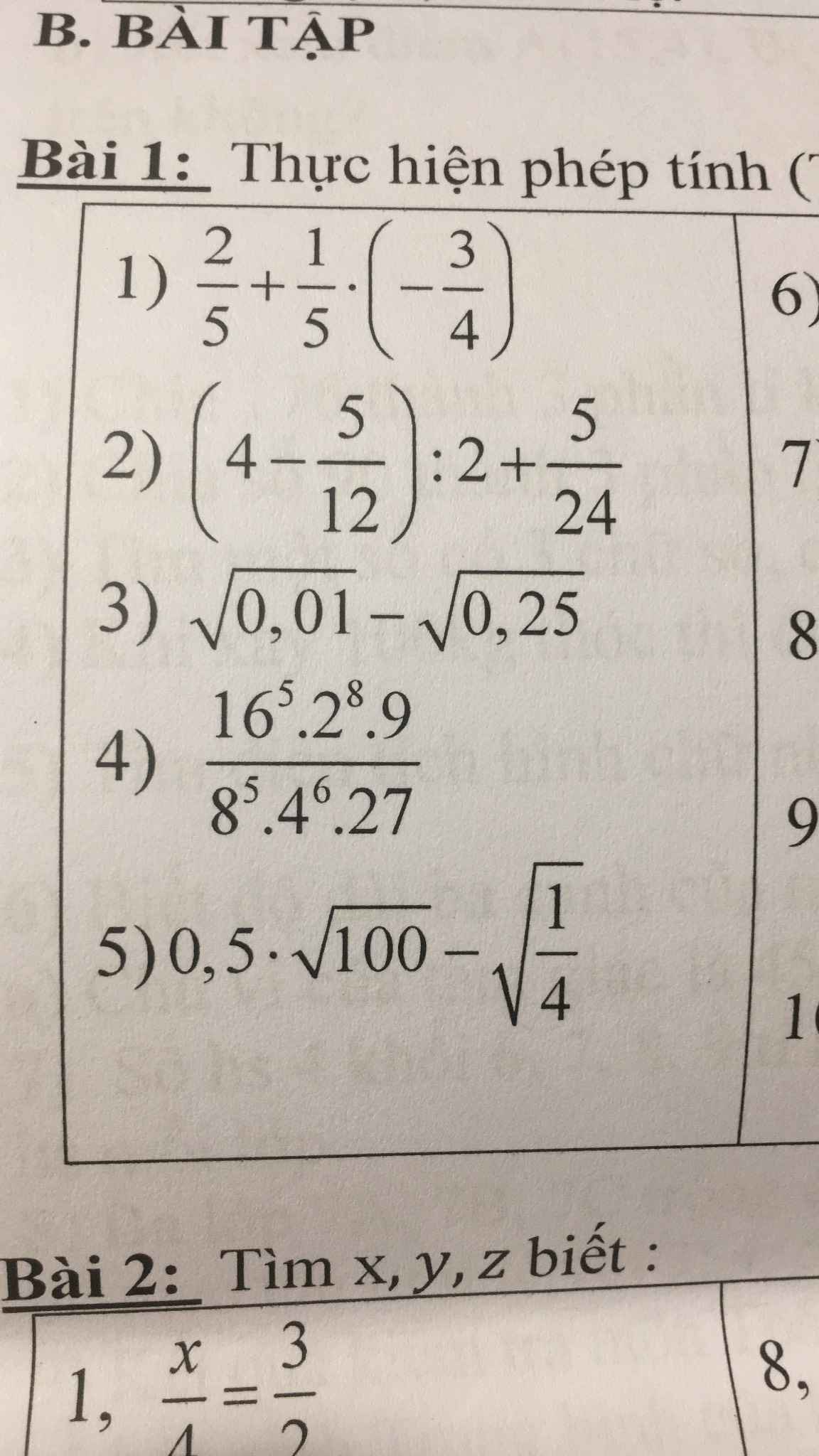
 mn giúp mik vs ạ. Mik đang cần gấp
mn giúp mik vs ạ. Mik đang cần gấp



À mà sợ sánh tĩnh từ á mn