số gam KCLO3 cần dùng để điều chế 2,4 gam oxi là
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a, PT: \(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
Ta có: \(n_{Fe_3O_4}=\dfrac{4,64}{232}=0,02\left(mol\right)\)
Theo PT: \(\left\{{}\begin{matrix}n_{Fe}=3n_{Fe_3O_4}=0,06\left(mol\right)\\n_{O_2}=2n_{Fe_3O_4}=0,04\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow m_{Fe}=0,06.56=3,36\left(g\right)\)
\(m_{O_2}=0,04.32=1,28\left(g\right)\)
b, Phần này đề bài cho là KMnO4 hay KClO3 vậy bạn?

Đáp án C
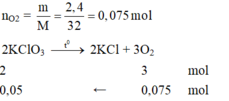
Theo PTHH có số mol K C l O 3 = 0,05 mol
Khối lượng K C l O 3 là:
m = n.M = 0,05. (39 + 35,5 + 16.3) = 6,125 gam.

\(n_{O_2}=\dfrac{m_{O_2}}{M_{O_2}}=\dfrac{48}{32}=1,5mol\)
\(2KClO_3\rightarrow\left(t^o,MnO_2\right)2KCl+3O_2\)
1 1,5 ( mol )
\(m_{KClO_3}=n_{KClO_3}.M_{KClO_3}=1.122,5=122,5g\)

\(a)\ n_{O_2} = \dfrac{6,72}{22,4} = 0,3(mol)\\ 2KMnO_4 \xrightarrow{t^o} K_2MnO_4 + MnO_2 + O_2\\ n_{KMnO_4} = 2n_{O_2} = 0,3.2 = 0,6(mol)\\ \Rightarrow m_{KMnO_4} = 0,6.158 = 94,8(gam)\\ b)\ n_{KClO_3} = \dfrac{24,5}{122,5} = 0,2(mol)\\ 2KClO_3 \xrightarrow{t^o} 2KCl + 3O_2\\ n_{O_2} = \dfrac{3}{2}n_{KClO_3} = 0,3(mol)\\ \Rightarrow m_{O_2} = 0,3.32 = 9,6(gam)\)
a) nO2 = \(\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
Pt: \(2KMnO_4\rightarrow K_2MnO_4+MnO_2+O_2\)
Theo pt: \(n_{KMnO_4}=2nO_2=0,6\left(mol\right)\Rightarrow m_{KMnO_4}=0,6.158=94,8g\)
b) \(n_{KClO_3}=\dfrac{24,5}{122,5}=0,3\left(mol\right)\)
\(Pt:2KClO_3\rightarrow2KCl+3O_2\)
\(nO_2=\dfrac{3}{2}n_{KClO_3}=0,45\left(mol\right)\Rightarrow mO_2=0,45.32=14,4g\)

a)Viết phương trình phàn ứng:
3Fe + 2O2 -------> Fe3O4
số mol của 2,32g Fe3O4 là: 2,32/232=0.01mol
=>nFe=0.01*3=0.03mol=>mFe=0.03*56=1.68...
=>nO2=0.01*2=0.02 mol
=>mO2=0.02*32=0.64(gam)
b)Phương trình phản ứng:
2KMnO4---->K2MnO4 + MnO2 + O2
Mà nO2=0.02 (mol) =>nKMnO4 = 0.02*2=0.04 (mol)
=>mKMnO4=0.04*158=6.32(gam).
a) PTHH: 3Fe + 2O2 --> Fe3O4
Số mol của oxit sắt là: 17,4 : 232 = 0,075 mol
Số mol của Fe là: 3 . 0,075 = 0,225 mol
Số mol của oxi là: 2 . 0,075 = 0,15 mol
Khối lượng của Fe cần dùng là: 0,225 . 56 = 12,6 gam
Thể tích khí oxi là : 0,15 . 22,4 = 3,36 lít

\(n_{Mg}=\dfrac{2,4}{24}=0,1\left(mol\right)\\ a,2Mg+O_2\rightarrow\left(t^o\right)2MgO\\ n_{O_2}=\dfrac{0,1}{2}=0,05\left(mol\right)\\ V_{O_2\left(đktc\right)}=0,05.22,4=1,12\left(l\right)\\ b,2KClO_3\rightarrow\left(t^o\right)2KCl+3O_2\\ n_{KClO_3}=\dfrac{0,05.2}{3}=\dfrac{1}{30}\left(mol\right)\\ \Rightarrow m_{KClO_3}=\dfrac{122,5}{30}=\dfrac{49}{12}\left(g\right)\)

a.\(n_{Cu}=\dfrac{6,4}{64}=0,1mol\)
\(2Cu+O_2\rightarrow\left(t^o\right)2CuO\)
0,1 0,05 ( mol )
\(V_{kk}=\left(0,05.22,4\right).5=5,6l\)
b.\(2KClO_3\rightarrow\left(t^o\right)2KCl+3O_2\)
1/30 0,05 ( mol )
\(m_{KClO_3}=\dfrac{1}{30}.122,5=4,08g\)

a.\(n_{Al_2O_3}=\dfrac{30,6}{102}=0,3mol\)
\(4Al+3O_2\rightarrow\left(t^o\right)2Al_2O_3\)
0,6 0,45 0,3 ( mol )
\(m_{Al}=0,6.27=16,2g\)
\(V_{O_2}=0,45.22,4=10,08l\)
\(V_{kk}=10,08.5=50,4l\)
b.\(2KClO_3\rightarrow\left(t^o,MnO_2\right)2KCl+3O_2\)
0,3 0,45 ( mol )
\(m_{KClO_3}=0,3.122,5=36,75g\)
c.\(2KClO_3\rightarrow\left(t^o,MnO_2\right)2KCl+3O_2\)
0,3 0,45 ( mol )
\(n_{KClO_3}=\dfrac{0,3}{75\%}=0,4mol\)
\(m_{KClO_3}=0,4.122,5=49g\)

a. \(n_{Fe_3O_4}=\dfrac{6,96}{232}=0,03\left(mol\right)\)
PTHH : 3Fe + 2O2 -to-> Fe3O4
0,09 0,06 0,03
\(m_{Fe}=0,09.56=5,04\left(g\right)\)
\(V_{O_2}=0,06.22,4=1,344\left(l\right)\)
b. PTHH : 2KCl + 3O2 -> 2KClO3
0,06 0,04
\(m_{KClO_3}=0,04.122,5=4,9\left(g\right)\)
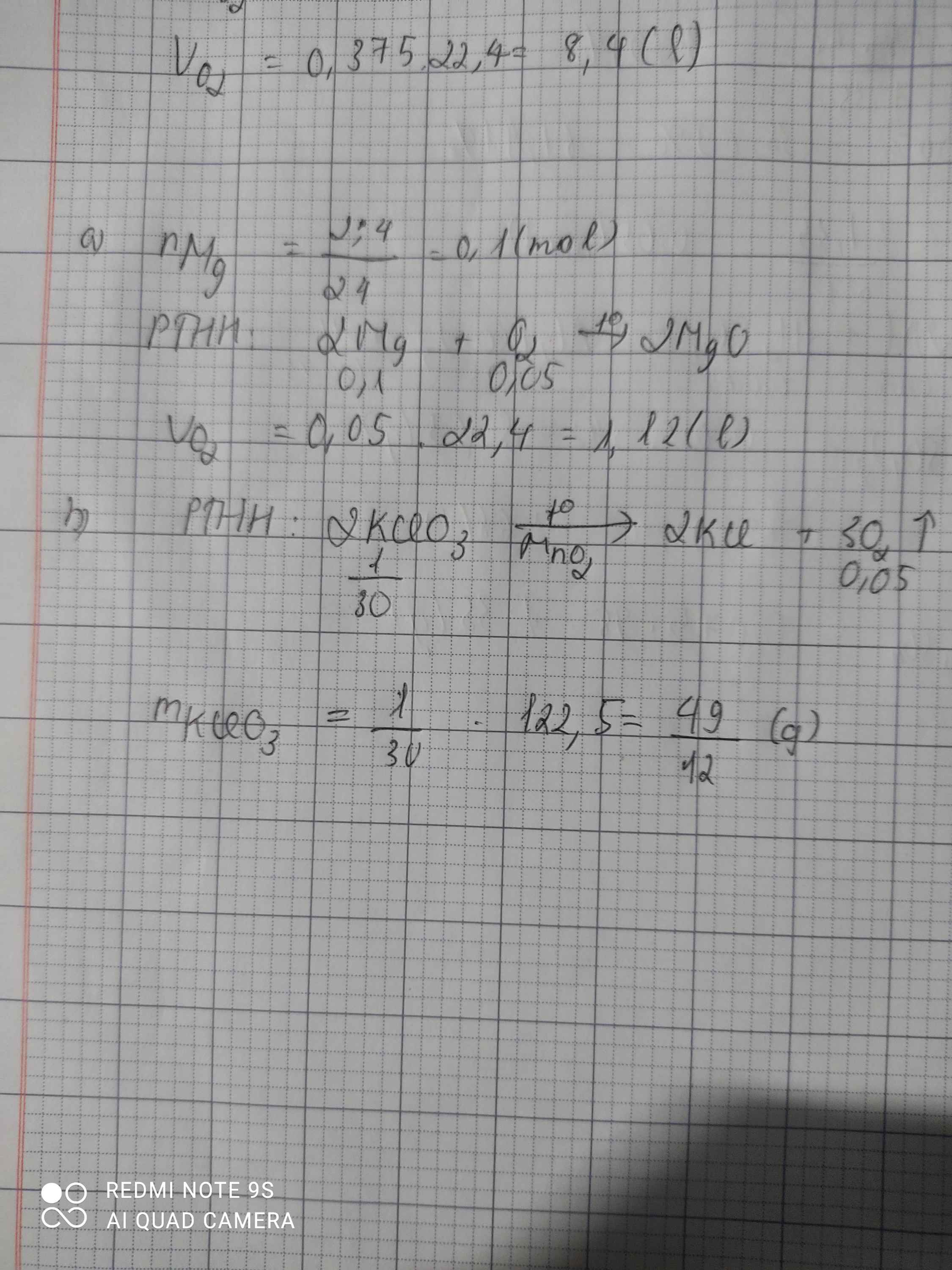
nO2 = \(\dfrac{2.4}{32}=0,075\left(mol\right)\)
PTHH: 2KClO3 ---to, MnO2---> 2KCl + 3O2
0,05 0,075
mKClO3 = 0,05.122,5 = 6,125 (g)