Cho a gam Na vào 200ml dung dịch CuSO4 0,5M sau phản ứng ta thu được 4,9 gam chất kết tủa màu xanh. Tính a
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Tính toán theo PTHH :
Mg + CuSO4 → Cu + MgSO4
Mg + FeSO4 → Fe + MgSO4
Ba(OH)2 + MgSO4 → BaSO4 + Mg(OH)2
Ba(OH)2 + FeSO4 → BaSO4 + Fe(OH)2
Mg(OH)2 → MgO + H2O
2 Fe(OH)2 + ½ O2 → Fe2O3 + 2 H2O
Giả sư dung dịch muối phản ứng hết
=> n Fe = n FeSO4 = 0,2 . 1= 0,2 mol => m Fe = 0,2 . 56 = 11,2 g
=> n Cu =n CuSO4 = 0,2 . 0,5 = 0,1 mol => m Cu = 0,1 . 64 = 6,4 g
=> m chất rắn = 11,2 + 6,4 = 17,6 g > 12 g > 6,4
=> kim loại Fe dư sau phản ứng Vì CuSO4 phản ứng trước sau đó mới đến FeSO4 phản ứng
CuSO4 đã hết và phản ứng với 1 phần FeSO4
12 g = m Cu + m Fe phản ứng = 6,4 g + m Fe phản ứng
=> m Fe = 5,6 g => n Fe = 0,1 mol => n FeSO4 dư = 0,2 – 0,1 = 0,1 mol
Theo PTHH : n Mg = 0,1 + 0,1 = 0,2 mol ( bắng số mol CuSO4 và FeSO4 phản ứng )
Theo PTHH : n Mg = n MgSO4 = n Mg(OH)2 = n MgO = 0,2 mol
n FeSO4 dư = n Fe(OH)2 = n Fe2O3 . 2 = 0,1 mol
=> n Fe2O3 = 0,1 mol
=> m chất rắn = m Fe2O3 + m MgO = 0,1 . 160 + 0,2 . 40 = 24 g

Tính toán theo PTHH :
Na + HCl → NaCl + ½ H2
Na + H2O → NaOH + ½ H2
3NaOH + AlCl3 → NaCl + Al(OH)3↓
NaOH + Al(OH)3↓→ NaAlO2 + 2 H2O ( có thể có )
n Na = 0,2 mol , n HCl = 0,25 . 0,2 = 0,05 mol , n AlCl3 = 0,4 . 0,2 = 0,08 mol
Theo PTHH : n Na = n HCl = 0,05 mol => Na dư : n Na dư = 0,2 – 0,05 = 0,15 mol
Theo PTHH : n Na = n NaOH = 0,15 mol
Theo PTHH : n NaOH = n AlCl3 . 3 ó 0,15 < 0,08 . 3 => AlCl3 dư => NaOH hết
=> n Al(OH)3 = 0,15 : 3 = 0,05 mol
=> m Al(OH)3 = 0,05 . 78 =3,9 g

VNaOH = 200ml = 0,2 (l)
CuCl2 + 2NaOH ---> Cu(OH)2 + 2NaCl
Kết tủa là Cu(OH)2
=> mCu(OH)2 = 9,8 / 98 = 0,1 (mol)
=> nNaOH = 0,2 (mol)
=> CM NaOH = n/V = 0,2 / 0,2 = 1M

\(n_{AlCl_3}=0.2\cdot1=0.2\left(mol\right)\)
\(n_{NaOH}=0.5V\left(mol\right)\)
\(n_{Al_2O_3}=\dfrac{5.1}{102}=0.05\left(mol\right)\)
\(2Al\left(OH\right)_3\underrightarrow{^{^{t^0}}}Al_2O_3+3H_2O\)
\(0.1...............0.05\)
TH1 : Al(OH)3 không bị hòa tan.
\(AlCl_3+3NaOH\rightarrow Al\left(OH\right)_3+3NaCl\)
\(0.1...........0.3................0.1\)
\(\Leftrightarrow V=\dfrac{0.3}{0.5}=0.6\left(l\right)\)
TH2 : Al(OH)3 bị hòa tan một phần
\(AlCl_3+3NaOH\rightarrow Al\left(OH\right)_3+3NaCl\)
\(0.2...........0.6................0.2\)
\(NaOH+Al\left(OH\right)_3\rightarrow NaAlO_2+2H_2O\)
\(0.5V-0.6...0.5V-0.6\)
\(n_{Al\left(OH\right)_3}=0.2+0.5V-0.6=0.1\left(mol\right)\)
\(\Rightarrow V=1\left(l\right)\)

nNa = 6.9 : 23 = 0.3 mol
4Na + O2 ->2 Na2O
mol : 0.3 -> 0.15
Na2O + H2O -> 2NaOH
mol : 0.15 -> 0.3
mdd = 0.15 x 62 + 140.7 = 150g
C% NaOH = 0.3x40: 150 x 100% = 8%

Đáp án D
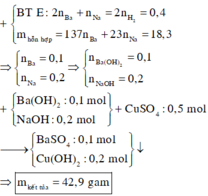
mKL = 137nBa + 23nNa ; nH2 = nBa + 0,5nNa = 0,2 mol
=> nBa = 0,1 ; nNa = 0,2 mol
=> nOH = 0,4 mol ; nCuSO4 = 0,5 mol
=> Kết tủa gồm : 0,1 mol BaSO4 và 0,2 mol Cu(OH)2
=> m = 42,9g
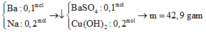
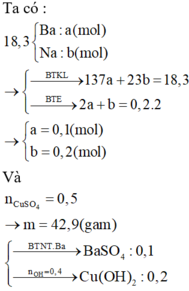
nCuSO4 = 0,2.0,5 = 0,1 (mol)
\(n_{Cu\left(OH\right)_2}=\dfrac{4,9}{98}=0,05\left(mol\right)\) => Trong dd còn CuSO4 (tức là CuSO4 dư)
PTHH: 2Na + 2H2O --> 2NaOH + H2
0,1<---------------0,1
2NaOH + CuSO4 --> Cu(OH)2 + Na2SO4
0,1<-----------------0,05
=> a = 0,1.23 = 2,3 (g)