Cho 26g kẽm phản ứng hoàn toàn với dung dịch a,Viết phương trình hóa học cho phản ứngaxit clohidric (dư) thu được kẽm clorua (ZnCl2) và khí hidroCho 26g kẽm phản ứng hoàn toàn với dung dịch
a,Viết phương trình hóa học cho phản ứngaxit clohidric (dư) thu được kẽm clorua (ZnCl2) và khí hidro
b,Tính thể tích khí hidro sinh ra ở(đktc)
c,Tính thể tích khối lượng mối thu được sau phản ứng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Zn}=\dfrac{26}{65}=0,4mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,4 0,4 0,4 ( mol )
\(V_{H_2}=0,4.22,4=8,96l\)
\(m_{ZnCl_2}=0,4.136=54,4g\)

a.b.c.\(n_{Zn}=\dfrac{m}{M}=\dfrac{13}{65}=0,2mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,2 0,2 0,2 ( mol )
\(m_{ZnCl_2}=n.M=0,2.136=27,2g\)
\(V_{H_2}=n.22,4=0,2.22,4=4,48l\)
d.\(n_{CuO}=\dfrac{m}{M}=\dfrac{32}{80}=0,4mol\)
\(CuO+H_2\rightarrow\left(t^o\right)Cu+H_2O\)
0,4 > 0,2 ( mol )
0,2 0,2 0,2 ( mol )
\(m_{chất.rắn}=m_{CuO\left(dư\right)}+m_{Cu}=0,2.80+0,2.64=16+12,8=28,8g\)
\(\%m_{CuO}=\dfrac{16}{28,8}.100=55,55\%\)
\(\%m_{Cu}=100\%-55,55\%=44,45\%\)

Zn + 2HCl --> ZnCl2 + H2
\(n_{Zn}=\dfrac{26}{65}=0,4\left(mol\right)\)
=> \(m_{ZnCl_2}=0,4.136=54,4\left(g\right)\)
\(V_{H_2}=0,4.22,4=8,96\left(l\right)\)
\(nZn=\dfrac{26}{65}=0,4mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,4-->0,8----->0,4------->0,4
\(mZnCl_2=136.0,4=54,4g\)
\(VH_2=0,4.22,4=8,96lít\)

a. \(n_{Zn}=\dfrac{6.5}{65}=0,1\left(mol\right)\)
PTHH : Zn + 2HCl -> ZnCl2 + H2
0,1 0,2 0,1
b. \(V_{H_2}=0,1.22,4=2,24\left(l\right)\)
c. \(m_{HCl}=0,2.36,5=7,3\left(g\right)\)
\(n_{Zn}=\dfrac{6,5}{65}=0,1mol\)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,1 0,2 0,1
\(V_{H_2}=0,1\cdot22,4=2,24l\)
\(m_{HCl}=0,2\cdot36,5=7,3g\)

a,\(n_{Zn}=\dfrac{6,5}{65}=0,1\left(mol\right)\)
PTHH: Zn + 2HCl ---> ZnCl2 + H2
0,1--------------->0,1------>0,1
b, => \(\left\{{}\begin{matrix}C_{M\left(ZnCl_2\right)}=\dfrac{0,1}{\dfrac{6}{1000}}=\dfrac{50}{3}M\\V_{H_2}=0,1.22,4=2,24\left(l\right)\end{matrix}\right.\)
c, \(n_{O_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
PTHH: 2H2 + O2 --to--> 2H2O
LTL: \(\dfrac{0,1}{2}< 0,1\)=> O2 dư
Theo pt: \(n_{O_2}=\dfrac{1}{2}n_{H_2}=\dfrac{1}{2}.0,1=0,05\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}m_{O_2\left(dư\right)}=\left(0,1-0,05\right).32=1,6\left(g\right)\\V_{O_2\left(dư\right)}=\left(0,1-0,05\right).22,4=1,12\left(l\right)\end{matrix}\right.\)

\(a.Zn+2HCl\rightarrow ZnCl_2+H_2\\ b.n_{Zn}=\dfrac{65}{65}=1\left(mol\right)\\ n_{ZnCl_2}=n_{Zn}=1\left(mol\right)\\ \Rightarrow m_{ZnCl_2}=1.136=136\left(g\right)\\ c.n_{H_2}=n_{Zn}=1\left(mol\right)\\ \Rightarrow V_{H_2}=1.22,4=22,4\left(l\right)\)

a) PTHH: \(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
b+c) Áp dụng Định luật bảo toàn khối lượng:
\(m_{Zn}+m_{HCl}=m_{ZnCl_2}+m_{H_2}\)
\(\Rightarrow m_{ZnCl_2}=m_{Zn}+m_{HCl}-m_{H_2}=6,5+7,3-1=12,8\left(g\right)\)
Có 3 lọ mất nhãn đựng 3 dung dịch không màu NaCl H2SO4 K2SO4 trình bày phương pháp hóa học để nhận ra các chất trên. Viết phương trình phản ứng.
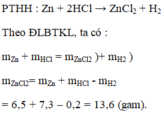
Zn+2HCl→ZnCl2+H2
0,4 0,4 0,4 ( mol )
nZn=\(\dfrac{26}{65}\)=0,4mol
VH2=0,4.22,4=8,96l
mZnCl2=0,4.136=54,4g