Thực hiện 2 thí nghiệm sau:
Thí nghiệm 1: 2Al + 6HCl → 2AlCl3 + 3H2
Thí nghiệm 2: Ca + 2HCl → CaCl2 + H2
Nếu dùng một lượng mol nhôm và canxi bằng nhau thì kết luận nào sau đây là đúng về thể tích khí hidro ở đktc?
A. Khí hidro thoát ra ở thí nghiệm 1 ít hơn ở thí nghiệm 2
B. Khí hidro thoát ra ở thí nghiệm 1 bằng ở thí nghiệm 2
C. Khí hidro thoát ra ở thí nghiệm 1 nhiều hơn ở thí nghiệm 2
D. Khí hidro thoát ra ở thí nghiệm 1 gần bằng ở thí nghiệm 2
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Phản ứng này có thể dùng để điều chế hidro trong phòng thí nghiệm

a) Số mol canxi cacbonat tham gia phản ứng nCaCO3= 10/100 = 0,1 mol.
CaCO3 + 2HCl → CaCl2 + CO2 + H2O.
Theo phương trình hóa học, ta có: nCaCl2= nCaCO3 = 0,1 mol.
Khối lượng của canxi clorua tham gia phản ứng: mCaCl2 = 0,1 . (40 + 71) = 11,1 g.
b) Số mol canxi cacbonat tham gia phản ứng: nCaCO3= 5/100 = 0,05 mol.
Theo phương trình hóa học, ta có: nCO2= nCaCO3 = 0,05 mol.
Thể tích khí CO2 ở điều kiện phòng là: VCO2 = 24 . 0,05 = 1,2 lít.

Đáp án B
(1) FeCO3 + 2HCl → FeCl2 + CO2 + H2O.
Mg + 2HCl → MgCl2 + H2.
→ Tổng mol khí = 2a → V1 = 44,8a (lít).
(2) Bảo toàn e: 2n (Mg) = 3n (NO) → n (NO) = 2a/3 (mol) → V2 = 14,93 (lít)
(3) BT e: n (FeCO3) + 2n (Mg) = 3n (NO) → n (NO) = a mol và n (CO2) = a mol
→ V3 = 44,8 lít
→ V1 = V3 > V2

Phản ứng hóa học điều chế H2 trong phòng thí nghiệm là: a) và c)

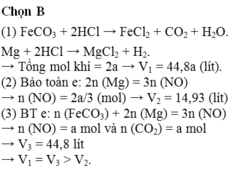
Đặt nAl = nCa = a (mol)
PTHH:
2Al + 6HCl -> 2AlCl3 + 3H2 (1)
a ---> 3a ---> a ---> 1,5a
Ca + 2HCl ---> CaCl2 + H2
a ---> 2a ---> a ---> a
VH2 (1) = 1,5a . 22,4 = 33,6a (l)
VH2 (2) = a . 22,4 = 22,4a (l)
Vậy thể tích khí H2 ở thí nghiệm 1 nhiều hơn thí nghiệm 2
c