Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án B
Thí nghiệm 1 cho m gam X vào H2O thu được V lít khí còn khí cho 2m gam vào NaOH thì thu được 3,5V lít tương đương khi cho m gam X vào NaOH thu được 1,75V lít.Do vậy trong X số mol Al nhiều hơn Na.
Gọi số mol của Na trong m gam X là x, suy ra khi cho m gam X vào H2O thì Al dư, nên Al phản ứng theo Na.
→ n H 2 = x + 3 x 2 = 2 x
Khi cho m gam X tác dụng với NaOH thu được 1,75V lít khí tức 3,5x mol khí. Lúc này cả Al và Na đều hết.
→ n A l = 3 , 5 x . 2 - x 3 = 2 x
Mặt khác cho 4m gam X vào HCl thu được 9V lít hay cho m gam X vào HCl thì thu được 2,25V lít hay 4,5x mol khí.
→ n M g = 4 , 5 x . 2 - x - 2 x . 3 2 = x
Vậy số mol Mg và Na bằng nhau

Đáp án D
• Đặt số mol của Na, Al, Mg trong m gam X lần lượt là a, b, c.
• Thí nghiệm 1: m gX + H2O dư → V lít khí
• Thí nghiệm 2: 2m g X + NaOH dư → 3,5V lít khí
Có 2 m m ≠ 3 , 5 V V => Chứng tỏ ở thí nghiệm 1, Al chưa bị hòa tan hết.
=> A sai.
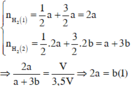
• Thí nghiệm 3: 4m g X + HCl dư → 9V lít khí
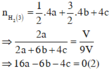
Từ (1) và (2) suy ra b=2c => B sai.
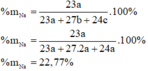
=> C sai.
• Có b=2a=2c => a = c => D đúng.

Đáp án B
Xét thí nghiệm 1 và 2 có tạo số mol kết tủa bằng nhau
=> 2 chất X và Y không thể là A l 3 + v à F e 2 + vì A l ( O H ) 3 tan trong NaOH và không tan trong N H 3
Do đó số kết tủa ở thí nghiệm 1 sẽ phải nhỏ hơn thí nghiệm 2 => không thỏa mãn đề bài

Đáp án A
P1: nFe(OH)2 = 3,6/90 = 0,04 mol => nFe2+ = 0,04 mol
P2:
Fe2+: x mol
H+: y mol
Cl-: 2x + y
3Fe2+ + 4H+ + NO3- → 3Fe3+ + NO + 2H2O
0,06 ← 0,08 ← 0,02
=> y = 0,08
Fe2+ + Ag+ → Fe3+ + Ag
x-0,06 → x-0,06
Ag+ + Cl- → AgCl
2x+y → 2x+y
=> 108(x-0,06) + 143,5(2x+y) = 68,2 => x = 0,16
=> nFe phản ứng ban đầu = nH2 = 0,04+0,16 = 0,2 mol => VH2 = 4,48 lít

Đáp án A
P1: nFe(OH)2 = 3,6/90 = 0,04 mol
=> nFe2+ = 0,04 mol
P2:
Fe2+: x mol
H+: y mol
Cl-: 2x + y
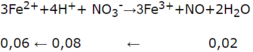
=> y = 0,08
Fe2++Ag+→Fe3++Ag
x-0,06 → x-0,06
Ag+ + Cl- → AgCl
2x+y → 2x+y
=> 108(x-0,06) + 143,5(2x+y) = 68,2 => x = 0,16
=> nFe phản ứng ban đầu = nH2 = 0,04+0,16 = 0,2 mol => VH2 = 4,48 lít


Đáp án D