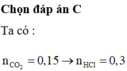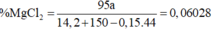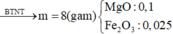Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nCO2 = 0,15 mol
MgCO3 + 2HCl ---> MgCl2 + CO2 + H2O
0.1 0,1 --> 0,1
RCO3 + 2HCl ---> RCl2 + CO2 + H2O
0,05 <---- (0,15-0,1)
Ta thấy: n HCl = 2n CO2 = 2.0,15 = 0,3 mol
m dd HCl = (0,3.36,5).100/7,3 = 150g
m CO2 = 0,15.44 = 6,6g
m dd sau phản ứng = m X + m dd HCl - m CO2 = 157,6 g
m MgCl2 = m dd sau phản ứng.C%/100 ~ 9,5g
n MgCl2 = 0,1 mol (thế vào pt trên)
Ta có: m RCO3 = m X - m MgCO3
=> 0,05(R + 60) = 14,2 - 0,1.84
=> R = 56
Vậy R là Fe
Chúc em học tốt!!

Gọi: M là NTK của R
a là số oxi hóa của R trong muối --> CTPT muối của R là R(2/a)CO3.
a) Từ nCO2 = n hỗn hợp = 0,5 nHCl = 3,36/22,4 = 0,15
--> nHCl = 0,15 x 2 = 0,3 mol nặng 0,3 x 36,5 = 10,95 gam.
--> dung dịch axit HCl 7,3% nặng 10,95/0,073 = 150 gam.
Mà
m dung dịch sau phản ứng = m dung dịch axit + m C - m CO2 bay ra
= 150 + 14,2 - (0,15 x 44) = 157,6 gam
--> m MgCl2 = 0,06028 x 157,6 = 9,5 gam
--> n MgCl2 = 9,5/95 = 0,1 mol = n MgCO3
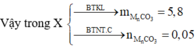
--> m MgCO3 = 0,1 x 84 = 8,4 gam chiếm 8,4/14,2 = 59,154929%
--> m R(2/a)CO3 = 14,2 - 8,4 = 5,8 gam chiếm 5,8/14,2 = 40,845071%
--> n R(2/a)CO3 = 0,15 - 0,1 = 0,05 mol.
--> PTK của R(2/a)CO3 = 5,8/0,05 = 116.
--> 2M/a = 116 - 60 = 56 hay M = 23a.
Chọn a = 2 với M = 56 --> R là Fe.
b) Khối lượng chất rắn sau khi nung đến khối lượng không đổi là khối lượng của 0,1 mol MgO và 0,05 mol FeO(1,5). (FeO(1,5) là cách viết khác của Fe2O3. Cũng là oxit sắt 3 nhưng PTK chỉ bằng 80).
m chất rắn sau khi nung = (0,1 x 40) + (0,05 x 80) = 8 gam.

Mk trình bày lại nhé
Gọi CTHH của muối cacbonat của R là R2(CO3)n ( n là hóa trị của R)
MgCO3 + 2HCl → MgCl2 + CO2↑ + H2O (1)
R2(CO3)n + 2nHCl → 2RCln + nCO2↑ + nH2O (2)
nCO2 =\(\frac{3,36}{22,4}\) = 0,15 mol
nHCl p.ứ = 2nCO2 = 0,3 mol
mHCl = 0,3 . 36,5 = 10,95 (g)
mdd HCl = \(\frac{10,95}{7,3}\). 100 = 150 (g)
mD = mC + mdd HCl - mCO2
= 14,2 + 150 - 0,15 . 44
= 157,6 (g)
mMgCl2 = 157,6 . 6,028% = 9,5 (g)
nMgCl2 = \(\frac{9,5}{95}\) = 0,1 (mol)
Theo (1): nMgCO3 = nCO2 (1) = nMgCl2 = 0,1 mol
nCO2 (2) = 0,15 - 0,1 = 0,05 mol
Theo (2): nR2(CO3)n =\(\frac{nCO2\left(2\right)}{n}=\frac{0,05}{n}\)
mC = mMgCO3 + mR2(CO3)n
→ 0,1 . 84 +\(\frac{0,05}{n}\)
. (2MR + 60n) = 14,2
→ MR = 28n
→ n = 2; MR = 56
→ R là Sắt
%mMgCO3 = 0,1 . 84 : 14,2 . 100% = 59,15%
%mFeCO3 = 100% - 59,15% = 40,85%

\(MgCO_3\left(a\right)+2HCl\rightarrow MgCl_2\left(a\right)+H_2O+CO_2\left(a\right)\)
\(R_2\left(CO_3\right)_x\left(b\right)+2xHCl\rightarrow2RCl_x+xH_2O+xCO_2\left(bx\right)\)
Gọi a,b lần lượt là số mol của MgCO3, R2(CO3)x trong A(a,b > 0; x là hóa trị của R \(\in N\)*)
\(n_{CO_2}=0,15\left(mol\right)\Rightarrow a+bx=0,15\left(I\right)\)
\(m_{HCl}=0,15.36,5.2=10,95\left(g\right)\)
\(\Rightarrow m_{ddHCl}=10,95.7,3\%=150\left(g\right)\)
\(m_{ddsaupư}=m_A+m_{ddHCl}-m_{CO_2}=14,2+150-0,15.44=157,6\left(g\right)\)
\(\Rightarrow m_{ddE}=32,4+157,6=190\left(g\right)\)
Vì \(\%MgCl_2\left(trongE\right)=5\%\Rightarrow\dfrac{9500a}{190}=5\)
\(\Rightarrow a=0,1\)
Thay vào (I) :
\(\Rightarrow bx=0,15-0,1=0,05\left(II\right)\)
Do mA = 14,2g \(\Rightarrow8,4+b\left(2M_R+60x\right)=14,2\)
\(\Rightarrow2bM_R+60bx=5,8\left(III\right)\)
Thay (II) vào (III) \(\Rightarrow2bM_R=2,8\Rightarrow M_R=28x\)
Kẻ bảng biện luận x = I, II, hoặc III
\(\Rightarrow R\) là Fe (II) .
\(\%m_{MgCO_3}\approx59,15\%\)
\(\%m_{FeCO_3}=40,85\%\)