Sục 1.12lit hỗn hợp CH4 C2H2 (đktc) vào dung dịch Br2 dư thấy có 4.8gam br2 phản ứng ? tính % về thể tích khí trong hỗn hợp
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Ta có: \(n_{Br_2}=\dfrac{48}{160}=0,3\left(mol\right)\)
PT: \(C_2H_2+2Br_2\rightarrow C_2H_2Br_4\)
____0,15___0,3 (mol)
\(\Rightarrow\left\{{}\begin{matrix}V_{C_2H_2}=0,15.22,4=3,36\left(l\right)\\V_{CH_4}=2,24\left(l\right)\end{matrix}\right.\)
Bạn tham khảo nhé!

a, \(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
b, \(n_{Br_2}=\dfrac{16}{160}=0,1\left(mol\right)\)
\(n_{C_2H_4}=n_{Br_2}=0,1\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}\%V_{C_2H_4}=\dfrac{0,1.22,4}{3,36}.100\%\approx66,67\%\\\%V_{CH_4}\approx33,33\%\end{matrix}\right.\)

Đáp án B
0,2 mol hh khí gồm CH4 và C2H2 qua dd brom dư thấy nhạt màu và có 0,1 mol khí thoát ra.
• Khí thoát ra là CH4 → nCH4 = 0,1 mol
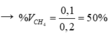

Ta có: m dd Br2 tăng = mC2H4 = 2,8 (g)
\(\Rightarrow n_{C_2H_4}=\dfrac{2,8}{28}=0,1\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}\%V_{C_2H_4}=\dfrac{0,1.22,4}{3,36}.100\%\approx66,67\%\\\%V_{CH_4}\approx33,33\%\end{matrix}\right.\)
Có: \(n_{CH_4}=\dfrac{3,36}{22,4}-0,1=0,05\left(mol\right)\)
⇒ m hh = mCH4 + mC2H4 = 0,05.16 + 0,1.28 = 3,6 (g)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{CH_4}=\dfrac{0,05.16}{3,6}.100\%\approx22,22\%\\\%m_{C_2H_4}\approx77,78\%\end{matrix}\right.\)

nhh khí = 2,24/22,4 = 0,1 (mol)
nC2H4 = 1,4/28 = 0,05 (mol)
%VC2H4 = 0,05/0,1 = 50%
%VC2H6 = 100% - 50% = 50%

PT: \(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
\(C_2H_2+2Br_2\rightarrow C_2H_2Br_4\)
Gọi: \(\left\{{}\begin{matrix}n_{C_2H_4}=x\left(mol\right)\\n_{C_2H_2}=y\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow x+y=\dfrac{2,24}{22,4}=0,1\left(mol\right)\left(1\right)\)
\(n_{Br_2}=n_{C_2H_4}+2n_{C_2H_2}=x+2y=\dfrac{24}{160}=0,15\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow x=y=0,05\left(mol\right)\)
\(\Rightarrow\%V_{C_2H_4}=\%V_{C_2H_2}=\dfrac{0,05.22,4}{2,24}.100\%=50\%\)


\(n_{Br_2} = \dfrac{4,8}{160} = 0,03(mol)\\ C_2H_2 + 2Br_2 \to C_2H_2Br_4\\ n_{C_2H_2}= \dfrac{1}{2}n_{Br_2} = 0,015(mol)\\ \%V_{C_2H_2} = \dfrac{0,015.22,4}{1,12}.100\% = 30\%\\ \%V_{CH_4} = 100\% -30\%=70\%\)