a)Tính thể tích khí H2 (đktc) cần dùng để khử hoàn toàn 24g CuO
b)Để có được lượng khí H2 dùng cho phản ứng trên , cần phải hòa tan bao nhieu gam sắt và dung dịch HCl dư
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

\(n_{Fe_3O_4}=\dfrac{24}{232}=\dfrac{3}{29}\left(mol\right)\)
PTHH :
\(Fe_3O_4+4H_2\underrightarrow{t^o}3Fe+4H_2O\)
3/29 9/29
\(Fe+2HCl\rightarrow FeCl_2+H_2\uparrow\)
9/29 18/29
\(c,V_{HCl}=\dfrac{\dfrac{18}{29}}{1,5}=\dfrac{12}{29}\left(l\right)\)

a, \(Fe_2O_3+3H_2\underrightarrow{t^o}2Fe+3H_2O\)
b, \(n_{Fe_2O_3}=\dfrac{24}{160}=0,15\left(mol\right)\)
Theo PT: \(n_{H_2}=3n_{Fe_2O_3}=0,45\left(mol\right)\)
\(\Rightarrow V_{H_2}=0,45.22,4=10,08\left(l\right)\)
c, n\(n_{Fe}=2n_{Fe_2O_3}=0,3\left(mol\right)\)
PT: \(Fe+2HCl\rightarrow FeCl_2+H_2\)
Theo PT: \(n_{HCl}=2n_{Fe}=0,6\left(mol\right)\Rightarrow V_{HCl}=\dfrac{0,6}{1,5}=0,4\left(M\right)\)

a. Để tính khối lượng HCl đã dùng, ta cần biết số mol của Al đã phản ứng với HCl. Ta sử dụng phương trình phản ứng:
2Al + 6HCl → 2AlCl3 + 3H2
Theo đó, 2 mol Al tương ứng với 6 mol HCl. Vậy số mol HCl cần để phản ứng với 2,7 g Al là:
n(HCl) = n(Al) x (6/2) = 2,7/(27x2) x 6 = 0,05 mol
Khối lượng HCl tương ứng là:
m(HCl) = n(HCl) x M(HCl) = 0,05 x 36,5 = 1,825 g
Vậy khối lượng HCl đã dùng là 1,825 g.
b. Theo phương trình phản ứng, 2 mol Al tạo ra 3 mol H2. Vậy số mol H2 tạo ra từ 2,7 g Al là:
n(H2) = n(Al) x (3/2) = 2,7/(27x2) x 3 = 0,025 mol
Theo định luật Avogadro, 1 mol khí ở ĐKTC chiếm thể tích 22,4 L. Vậy thể tích H2 thu được là:
V(H2) = n(H2) x 22,4 = 0,025 x 22,4 = 0,56 L
P.c. CuO + H2 → Cu + H2O
Khối lượng CuO cần để khử hết 0,025 mol H2 là:
n(CuO) = n(H2)/2 = 0,0125 mol
m(CuO) = n(CuO) x M(CuO) = 0,0125 x 79,5 = 0,994 g
Vậy để khử hết H2, ta cần dùng 0,994 g CuO. Nếu dùng toàn bộ lượng H2 bay ra, chất CuO sẽ bị khử hoàn toàn thành Cu và không còn chất nào còn dư.

PTHH : \(Fe_3O_4+4H_2\rightarrow3Fe+4H_2O\)
.............0,05........0,2.......0,15.........
Có : \(\left\{{}\begin{matrix}n_{H_2}=0,2\left(mol\right)\\n_{Fe_3O_4}=0,075\left(mol\right)\end{matrix}\right.\)
- Theo phương pháp ba dòng .
=> Sau phản ứng H2 hết, Fe3O4 còn dư ( dư 0,025 mol )
=> \(m=m_{Fe3o4du}+m_{Fe}=14,2\left(g\right)\)
b, \(Fe+2HCl\rightarrow FeCl_2+H_2\)
...0,15.....0,3.........0,15..............
\(Fe_3O_4+8HCl\rightarrow2FeCl_3+FeCl_2+4H_2O\)
.0,025......0,2..........0,05.........0,025...................
Có : \(V=\dfrac{n}{C_M}=\dfrac{n}{1}=n_{HCl}=0,2+0,3=0,5\left(l\right)\)
Lại có : \(m_M=m_{FeCl2}+m_{FeCl3}=30,35\left(g\right)\)

nmg = \(\dfrac{3,6}{24}\) = 0,15 ( mol )
Mg + 2HCl → MgCl2 + H2
1 2 1 1
0,15 0,3 0,15
a) mHCl = 0,3 . 36,5 = 10,95 ( g )
b) VH2 = 0,15 . 22,4 = 3,36 ( l )
Tick dùm tớ nha, tớ giải theo trường có gì sai bỏ qua nhaaa

Đáp án D
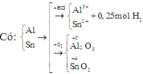
Vì trong hai thí nghiệm số oxi hóa của Sn trong sản phẩm thu được khác nhau nên ta cần tìm số mol cụ thể của mỗi kim loại trong hỗn hợp.
Một số bạn không để ý đến tính chất đặc biệt này của Sn mà cho rằng số oxi hóa của cả hai kim loại trong sản phẩm ở hai thí nghiệm là như nhau nên áp dụng ngay định luật bảo toàn mol electron:
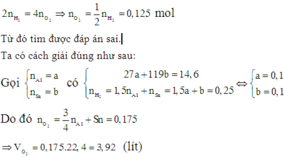

PTHH: \(Fe_3O_4+4CO\xrightarrow[]{t^o}3Fe+4CO_2\uparrow\)
\(Fe+H_2SO_4\rightarrow FeSO_4+H_2\uparrow\)
\(H_2+\dfrac{1}{2}O_2\xrightarrow[]{t^o}H_2O\)
Ta có: \(n_{Fe_3O_4}=\dfrac{23,2}{232}=0,1\left(mol\right)\) \(\Rightarrow n_{Fe}=0,3\left(mol\right)=n_{H_2SO_4}=n_{H_2}=n_{H_2O}\)
\(\Rightarrow\left\{{}\begin{matrix}V_{H_2}=0,3\cdot22,4=6,72\left(l\right)\\V_{ddH_2SO_4}=\dfrac{0,3}{0,5}=0,6\left(l\right)\\V_{H_2O}=\dfrac{0,3\cdot18}{D_{nước}}=5,4\left(ml\right)\end{matrix}\right.\)
*P/s: \(D_{nước}=1g/ml\)
câu trả lời của em đâu???:)