Bải tập: Đốt cháy 5,6 lít hỗn hợp metan và etylen cần dung 13,44 lít khi oxi (Các
khí đo ở đktc).
a) Xác định thành phần phần trăm thể tích mỗi chất khi trong hỗn hợp ban đầu?
b)Dẫn toàn bộ khí cacbon đioxit sinh ra nói trên vào dung dịch KOH lấy dư. Tinh
khối lượng muối tạo thành?
c) Cho hỗn hợp khí trên tác dụng với 300 ml dung dịch brom nồng độ 1M, dung
dịch brom nhạt màu hay mất màu? Tinh khối lượng đibrom etan?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a.\(n_{hh}=\dfrac{13,44}{22,4}=0,6mol\)
\(n_{C_2H_2Br_4}=\dfrac{6,72}{22,4}=0,3mol\)
\(C_2H_2+2Br_2\rightarrow C_2H_2Br_4\)
0,3 0,3 ( mol )
\(\%C_2H_2=\dfrac{0,3}{0,6}.100=50\%\)
\(\%CH_4=100\%-50\%=50\%\)
b.
\(CH_4+2O_2\rightarrow\left(t^o\right)CO_2+2H_2O\)
0,3 0,6 ( mol )
\(2C_2H_2+5O_2\rightarrow\left(t^o\right)4CO_2+2H_2O\)
0,3 0,75 ( mol )
\(V_{O_2}=\left(0,6+0,75\right).22,4=1,35.22,4=30,24l\)

Gọi: \(\left\{{}\begin{matrix}n_{CO}=x\left(mol\right)\\n_{H_2}=y\left(mol\right)\end{matrix}\right.\)
⇒ 28x + 2y = 11,8 (1)
PT: \(2CO+O_2\underrightarrow{t^o}2CO_2\)
\(2H_2+O_2\underrightarrow{t^o}2H_2O\)
Ta có: \(n_{O_2}=\dfrac{7,84}{22,4}=0,35\left(mol\right)\)
Theo PT: \(n_{O_2}=\dfrac{1}{2}n_{CO}+\dfrac{1}{2}n_{H_2}=\dfrac{1}{2}x+\dfrac{1}{2}y\left(mol\right)\)
⇒ x + y = 0,7 (2)
Từ (1) và (2) ⇒ x = 0,4 (mol), y = 0,3 (mol)
a, \(\left\{{}\begin{matrix}\%m_{CO}=\dfrac{0,4.28}{11,8}.100\%\approx94,9\%\\\%m_{H_2}\approx5,1\%\end{matrix}\right.\)
b, Ở cùng điều kiện nhiệt độ và áp suất, % số mol cũng là % thể tích.
\(\Rightarrow\left\{{}\begin{matrix}\%V_{CO}=\dfrac{0,4}{0,7}.100\%\approx57,14\%\\\%V_{H_2}\approx42,86\%\end{matrix}\right.\)
Bạn tham khảo nhé!
PTHH:
\(2CO+O_2\overset{t^o}{--->}2CO_2\left(1\right)\)
\(2H_2+O_2\overset{t^o}{--->}2H_2O\left(2\right)\)
Ta có: \(n_{O_2}=\dfrac{7,84}{22,4}=0,35\left(mol\right)\)
Gọi x, y lần lượt là số mol của CO và H2
a. Theo PT(1): \(n_{O_2}=\dfrac{1}{2}.n_{CO}=\dfrac{1}{2}x\left(mol\right)\)
Theo PT(2): \(n_{O_2}=\dfrac{1}{2}.n_{H_2}=\dfrac{1}{2}y\left(mol\right)\)
\(\Rightarrow\dfrac{1}{2}x+\dfrac{1}{2}y=0,35\) (*)
Theo đề, ta có: \(28x+2y=11,8\) (**)
Từ (*) và (**), ta có HPT:
\(\left\{{}\begin{matrix}\dfrac{1}{2}x+\dfrac{1}{2}y=0,35\\28x+2y=11,8\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,4\\y=0,3\end{matrix}\right.\)
\(\Rightarrow m_{H_2}=2.0,3=0,6\left(g\right)\)
\(\Rightarrow\%_{m_{H_2}}=\dfrac{0,6}{11,8}.100\%=5,08\%\)
\(\%_{m_{CO}}=100\%-5,08\%=94,92\%\)
b. \(\%_{V_{CO}}=\dfrac{0,4}{0,4+0,3}.100\%=57,1\%\)
\(\%_{V_{H_2}}=100\%-57,1\%=42,9\%\)

a, \(CH_4+2O_2\underrightarrow{^{t^o}}CO_2+2H_2O\)
\(C_2H_4+3O_2\underrightarrow{^{t^o}}2CO_2+2H_2O\)
b, Gọi: \(\left\{{}\begin{matrix}n_{CH_4}=x\left(mol\right)\\n_{C_2H_4}=y\left(mol\right)\end{matrix}\right.\) \(\Rightarrow x+y=\dfrac{4,48}{22,4}=0,2\left(mol\right)\left(1\right)\)
Theo PT: \(n_{O_2}=2n_{CH_4}+3n_{C_2H_4}=2x+3y=\dfrac{15,68}{22,4}=0,7\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=-0,1\\y=0,3\end{matrix}\right.\)
Đến đây thì ra số mol âm, bạn xem lại đề nhé.

Cho hỗn hợp qua dung dịch brom dư
\(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
Khí thoát ra là \(CH_4\)
\(CH_4+2O_2\rightarrow^{t^o}CO_2+2H_2O\)
\(Ca\left(OH\right)_2+CO_2\rightarrow CaCO_3+H_2O\)
Ta có:
\(n_{CaCO_3}=\frac{40}{100}=0,4mol=n_{CO_2}=n_{CH_4}\)
\(\rightarrow V_{CH_4}=0,4.22,4=8,96l\)
\(\rightarrow\%V_{CH_4}=\frac{8,96}{13,56}=66\%\rightarrow\%V_{C_2H_4}=34\%\)

a, \(C_2H_2+2Br_2\rightarrow C_2H_2Br_4\)
b, - Khí thoát ra là CH4 ⇒ VCH4 = 6,72 (l)
\(\Rightarrow\left\{{}\begin{matrix}\%V_{CH_4}=\dfrac{6,72}{13,44}.100\%=50\%\\\%V_{C_2H_2}=50\%\end{matrix}\right.\)
a. PTHH: \(C_2H_2+2Br_2\rightarrow C_2H_2Br_4\)
a. Vì CH4 không phản ứng với dd Br2 nên
\(V_{CH_4}=6,72\left(l\right)\)
\(\%V_{CH_4}=\dfrac{6,72}{13,44}x100\%=50\%\)
\(\%V_{C_2H_2}=100\%-50\%=50\%\)

Theo gt ta có: $n_{O_2}=0,6(mol);n_{hh}=0,25(mol)$
a, $CH_4+2O_2\rightarrow CO_2+2H_2O$
$C_2H_4+3O_2\rightarrow 2CO_2+2H_2O$
Gọi số mol CH4 và C2H4 lần lượt là a;b(mol)
Ta có: $a+b=0,25;2a+3b=0,6\Rightarrow a=0,15;b=0,1$
b, Suy ra $\%V_{CH_4}=60\%;\%V_{C_2H_4}=40\%$
c, Ta có: $n_{CaCO_3}=n_{CO_2}=0,15+0,1.2=0,35(mol)\Rightarrow m_{CaCO_3}=35(g)$
\(a)\\ CH_4 + 2O_2 \xrightarrow{t^o} CO_2 + 2H_2O\\ C_2H_4 + 3O_2 \xrightarrow{t^o} 2CO_2 + 2H_2O\\ b)\ V_{CH_4} = a(lít) ; V_{C_2H_4} = b(lít)\\ \Rightarrow a + b = 5,6(1)\\ V_{O_2} = 2a + 3b = 13,44(2)\\ (1)(2)\Rightarrow a = 3,36 ; b = 2,24\\ \%V_{CH_4} = \dfrac{3,36}{5,6}.100\% = 60\%\\ \%V_{C_2H_4} = 40\%\\ c) V_{CO_2} = a + 2b = 7,84(lít)\\\)
\(CO_2 + Ca(OH)_2 \to CaCO_3 + H_2O\\ n_{CaCO_3} = n_{CO_2} = \dfrac{7,84}{22,4} = 0,35(mol)\\ \Rightarrow m_{CaCO_3} = 0,35.100 = 35(gam)\)

\(n_{hhkhí}=\dfrac{2,8}{22,4}=0,125\left(mol\right)\\ n_{O_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\\ Gọi\left\{{}\begin{matrix}n_{CH_4}=a\left(mol\right)\\n_{C_2H_2}=b\left(mol\right)\end{matrix}\right.\)
PTHH:
CH4 + 2O2 \(\underrightarrow{t^o}\) CO2 + 2H2O
a 2a a
2C2H2 + 5O2 \(\underrightarrow{t^o}\) 4CO2 + 2H2O
b 2,5b 2b
Hệ phương trình: \(\left\{{}\begin{matrix}a+b=0,125\\2a+2,5b=0,3\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,025\left(mol\right)\\b=0,1\left(mol\right)\end{matrix}\right.\)
\(\%V_{C_2H_2}=\dfrac{0,1}{0,125}=80\%\\ \%_{CH_4}=100\%-80\%=20\%\)
nCO2 = 2.0,025 + 2.0,1 = 0,25 (mol)
PTHH: Ca(OH)2 + CO2 -> CaCO3 + H2O
0,25 0,25
=> mCaCO3 = 0,25.100 = 25 (g)
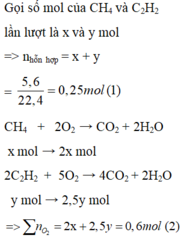

mik vẫn chưa hỉu lắm