Cho m gam hỗn hợp Al và Al2O3 tác dụng vừa hết với 450 ml dung dịch HCl 1M,
thu được 1,68 lít H2 đktc. Phần trăm khối lương của Al2O3 là:
A. 79,07% B. 20,93% C. 88,31% D. 71,57%
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
► Bảo toàn electron: 3nAl = 2nH2 ⇒ nAl = 0,02 mol.
"vừa đủ" ⇒ X chỉ chứa AlCl3 || 0,09 mol hay 0,13 mol NaOH cho cùng 1 lượng ↓
⇒ 0,09 mol NaOH thì ↓ chưa đạt cực đại và 0,13 mol NaOH thì ↓ bị hòa tan 1 phần.
⇒ n↓ = 0,09 ÷ 3 = 0,03 mol. ||► Mặt khác, khi bị hòa tan 1 phần thì:
nOH– = 4nAl3+ – n↓ ⇒ nAl3+ = (0,03 + 0,13) ÷ 4 = 0,04 mol.
Bảo toàn nguyên tố Al: nAl2O3 = 0,01 mol ||⇒ m = 1,56(g)

Đáp án D
► Bảo toàn electron: 3nAl = 2nH2 ⇒ nAl = 0,02 mol.
"vừa đủ" ⇒ X chỉ chứa AlCl3 || 0,09 mol hay 0,13 mol NaOH cho cùng 1 lượng ↓
⇒ 0,09 mol NaOH thì ↓ chưa đạt cực đại và 0,13 mol NaOH thì ↓ bị hòa tan 1 phần.
⇒ n↓ = 0,09 ÷ 3 = 0,03 mol. ||► Mặt khác, khi bị hòa tan 1 phần thì:
nOH– = 4nAl3+ – n↓ ⇒ nAl3+ = (0,03 + 0,13) ÷ 4 = 0,04 mol.
Bảo toàn nguyên tố Al: nAl2O3 = 0,01 mol ||⇒ m = 1,56(g)

Gọi số mol Al, Fe là a, b (mol)
=> 27a + 56b = 11,1 (1)
\(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
a----------------------->1,5a
Fe + 2HCl --> FeCl2 + H2
b------------------------>b
=> 1,5a + b = 0,3 (2)
(1)(2) => a = 0,1; b = 0,15
=> \(\left\{{}\begin{matrix}\%m_{Al}=\dfrac{0,1.27}{11,1}.100\%=24,32\%\\\%m_{Fe}=\dfrac{0,15.56}{11,1}.100\%=75,68\end{matrix}\right.\)

Đặt nAl=a(mol); nFe=b(mol) (a,b>0)
Ta có: nH2=8,96/22,4=0,4(mol)
PTHH: 2 Al + 6 HCl -> 2 AlCl3 + 3 H2
a_________3a____a____1,5a(mol)
Fe +2 HCl -> FeCl2 + H2
b__2b____b____b(mol)
Ta có hpt:
\(\left\{{}\begin{matrix}27a+56b=16,7\\1,5a+b=0,4\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,25\end{matrix}\right.\)
=> mAl= 0,1.27=2,7(g) =>%mAl= (2,7/16,7).100=16,17%
=> CHỌN B

Đáp án C
nH2 = 13,44: 22,4 = 0,6 mol
- Các phản ứng:
Al2O3 + 2NaOH → 2NaAlO2 + H2O
Al + NaOH → NaAlO2 + 1,5H2
Mol: 0,4 ← 0,6
=> %mAl = 0,4.27 / 31,2 = 34,6%
=> %mAl2O3 = 100 % - %mAl = 100% - 34,6% = 65,4%

\(n_{H_2}=\dfrac{13,44}{22,4}=0,6\left(mol\right)\)
\(2A1+2NAOH+2H_2O-2NaA10_2+H_2O\)
\(AI_2O_3=2NaOH+2NaOHA10_2+H_2O\)
\(n_{AI}=\dfrac{2}{3}n_{H_2}=\dfrac{2}{3}.0,6=0,4\left(mol\right)\)
\(m_{AI}=27.0,4=10,8\left(gam\right);mAI_2O_3=31,2-10,8=20,4\left(gam\right)\)
Biết làm mỗi câu A

a) 2Al + 6HCl -> 2AlCl3 + 3H2
Al2O3 + 6HCl -> 2AlCl3 + 3H2O
nH2 = 0,15mol => nAl=0,1mol => mAl=2,7g; mAl2O3 = 10,2g => nAl2O3 = 0,1mol
=>%mAl=20,93% =>%mAl2O3 = 79,07%
b) nHCl = 0,1.3+0,1.6=0,9 mol=>mHCl(dd)=100g
mddY=12,9+100-0,15.2=112,6g
mAlCl3=22,5g=>C%=19,98%
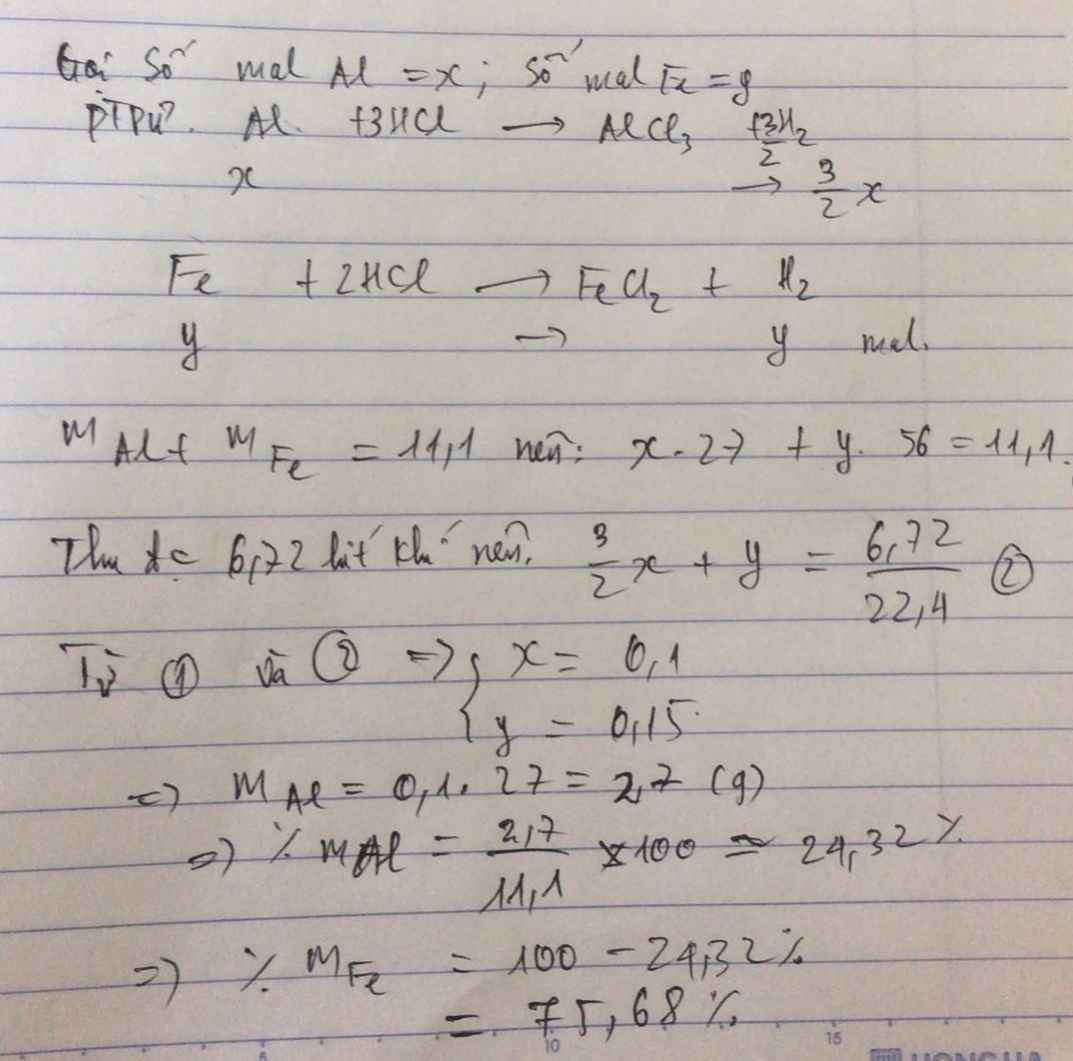
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\left(1\right)\\ Al_2O_3+6HCl\rightarrow2AlCl_3+H_2O\left(2\right)\\ n_{Al}=\dfrac{2}{3}n_{H_2}=0,05\left(mol\right)\\ n_{HCl\left(2\right)}=0,45-0,05.3=0,3\left(mol\right)\\ n_{Al_2O_3}=\dfrac{1}{6}n_{HCl\left(2\right)}=0,05\left(mol\right)\\ \%m_{Al_2O_3}=\dfrac{0,05.102}{0,05.27+0,05.102}.100=79,07\%\\ \Rightarrow ChọnA\)