Đốt cháy hoàn toàn 2 8 gam hỗn hợp gồm C và S , thể tích khí O2 (đktc)cần dùng là 3,36 lít. Tính phần trăm khối lượng của C trong hỗn hợp .
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a)
\(n_{Br_2}=\dfrac{8}{160}=0,05\left(mol\right)\)
PTHH: C2H4 + Br2 --> C2H4Br2
0,05<-0,05
=> \(n_{CH_4}=\dfrac{3,36}{22,4}-0,05=0,1\left(mol\right)\)
\(\%m_{CH_4}=\dfrac{0,1.16}{0,1.16+0,05.28}.100\%=53,33\%\)
\(\%m_{C_2H_4}=\dfrac{0,05.28}{0,1.16+0,05.28}.100\%=46,67\%\)
b)
PTHH: CH4 + 2O2 --to--> CO2 + 2H2O
0,1-->0,2
C2H4 + 3O2 --to--> 2CO2 + 2H2O
0,05--->0,15
=> \(V_{O_2}=\left(0,2+0,15\right).22,4=7,84\left(l\right)\)

Đáp án D
n M = 5 , 6 22 , 4 = 0 , 25 m o l
![]()
![]()
Bảo toàn nguyên tố oxi
![]()
![]()
Bảo toàn khối lượng:
m M = m C + m H + m N = 14 g a m
Gọi công thức chung của CH2=CHCH2NH2, H2NCH2CH2CH2NH2, CH3CH2CH2NH2,
CH3CH2NHCH3 là C3HnNm
→ hỗn hợp M gồm
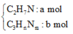
C2H7N → 2CO2
a → 2a
C3HnNm → 3CO2
b → 3b
Ta có hệ phương trình:
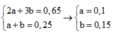
% m C H 3 C H 2 N H 2 = 0 , 145 14 100 % = 32 , 14 %

a/ \(2CO\left(0,2\right)+O_2\left(0,1\right)\rightarrow2CO_2\left(0,2\right)\)
\(2H_2\left(0,1\right)+O_2\left(0,05\right)\rightarrow2H_2O\left(0,1\right)\)
\(n_{H_2O}=\frac{1,8}{18}=0,1\)
\(n_{O_2}=\frac{3,36}{22,4}=0,15\)
Số mol O2 phản ứng ở phản ứng đầu là: \(0,15-0,05=0,1\)
\(\Rightarrow m_{CO_2}=0,2.44=8,8\)
b/ \(m_{CO}=0,2.28=5,6\)
\(m_{H_2}=0,1.2=0,2\)
c/ \(\%CO=\frac{0,2}{0,3}.100\%=66,67\%\)
\(\Rightarrow\%H_2=100\%-66,67\%=33,33\%\)

Gọi: \(\left\{{}\begin{matrix}n_{CO}=x\left(mol\right)\\n_{H_2}=y\left(mol\right)\end{matrix}\right.\)
⇒ 28x + 2y = 11,8 (1)
PT: \(2CO+O_2\underrightarrow{t^o}2CO_2\)
\(2H_2+O_2\underrightarrow{t^o}2H_2O\)
Ta có: \(n_{O_2}=\dfrac{7,84}{22,4}=0,35\left(mol\right)\)
Theo PT: \(n_{O_2}=\dfrac{1}{2}n_{CO}+\dfrac{1}{2}n_{H_2}=\dfrac{1}{2}x+\dfrac{1}{2}y\left(mol\right)\)
⇒ x + y = 0,7 (2)
Từ (1) và (2) ⇒ x = 0,4 (mol), y = 0,3 (mol)
a, \(\left\{{}\begin{matrix}\%m_{CO}=\dfrac{0,4.28}{11,8}.100\%\approx94,9\%\\\%m_{H_2}\approx5,1\%\end{matrix}\right.\)
b, Ở cùng điều kiện nhiệt độ và áp suất, % số mol cũng là % thể tích.
\(\Rightarrow\left\{{}\begin{matrix}\%V_{CO}=\dfrac{0,4}{0,7}.100\%\approx57,14\%\\\%V_{H_2}\approx42,86\%\end{matrix}\right.\)
Bạn tham khảo nhé!
PTHH:
\(2CO+O_2\overset{t^o}{--->}2CO_2\left(1\right)\)
\(2H_2+O_2\overset{t^o}{--->}2H_2O\left(2\right)\)
Ta có: \(n_{O_2}=\dfrac{7,84}{22,4}=0,35\left(mol\right)\)
Gọi x, y lần lượt là số mol của CO và H2
a. Theo PT(1): \(n_{O_2}=\dfrac{1}{2}.n_{CO}=\dfrac{1}{2}x\left(mol\right)\)
Theo PT(2): \(n_{O_2}=\dfrac{1}{2}.n_{H_2}=\dfrac{1}{2}y\left(mol\right)\)
\(\Rightarrow\dfrac{1}{2}x+\dfrac{1}{2}y=0,35\) (*)
Theo đề, ta có: \(28x+2y=11,8\) (**)
Từ (*) và (**), ta có HPT:
\(\left\{{}\begin{matrix}\dfrac{1}{2}x+\dfrac{1}{2}y=0,35\\28x+2y=11,8\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,4\\y=0,3\end{matrix}\right.\)
\(\Rightarrow m_{H_2}=2.0,3=0,6\left(g\right)\)
\(\Rightarrow\%_{m_{H_2}}=\dfrac{0,6}{11,8}.100\%=5,08\%\)
\(\%_{m_{CO}}=100\%-5,08\%=94,92\%\)
b. \(\%_{V_{CO}}=\dfrac{0,4}{0,4+0,3}.100\%=57,1\%\)
\(\%_{V_{H_2}}=100\%-57,1\%=42,9\%\)
2,8 hay 28
số liệu phải là 2,8 g hh nhé
C+O2-to>CO2
x-----x
S+O2-to>SO2
y----y
Ta có :\(\left\{{}\begin{matrix}12x+32y=2,8\\x+y=0,15\end{matrix}\right.\)
=>x=0,1 mol, y=0,05 mol
=>%mC=\(\dfrac{0,1.12}{2,8}.100=42,86\%\)
=>%mS=100-42,86=57,14%