Có 40,1 gam hỗn hợp X gồm Al và Fe2O3 .Đem nung nóng ,X để thực hiện phản ứng hoàn toàn sau 1 thời gian thu được m gam hỗn hợp rắn Y .Chia Y thành 2 phần bằng nhau :
-P1: hòa tan trong dung dịch NaOH dư thấy thoát ra khí H2
-P2:Hòa tan trong dung dịch HCl dư thấy thoát ra 4,48 lít khí H2
Phần trăm khối lượng của Al trong hỗn hợp X ?


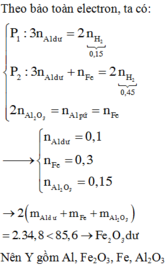

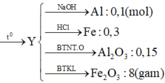



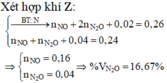

Gọi số mol Al, Fe2O3 mỗi phần lần lượt là a,b (mol) (a,b>0)
- Xét phần 2:
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\\ n_{H_2\left(P2\right)}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\\ n_{Al\left(P2\right)}=\dfrac{2}{3}.0,2=\dfrac{2}{15}\left(mol\right)\\ m_{Al\left(P2\right)}=\dfrac{2}{15}.27=1,8\left(g\right)\\ m_{P2}=\dfrac{40,1}{2}=20,05\left(g\right)\\ \%m_{\dfrac{Al\left(P2\right)}{P_2}}=\%m_{\dfrac{Al}{2Phần}}=\dfrac{1,8}{20,05}.100\approx8,978\%\)
P1: Do chất rắn tác dụng với NaOH có khí thoát ra
=> trong Y chứa Al
P2: Gọi (nAl; nFe; nAl2O3) = (a;b;c)
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
a---------------------->1,5a
Fe + 2HCl --> FeCl2 + H2
b---------------------->b
=> 1,5a + b = \(\dfrac{4,48}{22,4}=0,2\left(mol\right)\) (1)
mY = mX = 40,1
=> 54a + 112b + 204c = 40,1 (2)
PTHH: 2Al + Fe2O3 --to--> Al2O3 + 2Fe
=> \(\dfrac{n_{Fe}}{n_{Al_2O_3}}=\dfrac{2}{1}\) => \(\dfrac{b}{c}=\dfrac{2}{1}\) (3)
(1)(2)(3) => \(\left\{{}\begin{matrix}a=\dfrac{9}{890}\left(mol\right)\\b=\dfrac{329}{1780}\left(mol\right)\\c=\dfrac{329}{3560}\left(mol\right)\end{matrix}\right.\)
=> nAl = 2.(a + 2c) = \(\dfrac{347}{890}\left(mol\right)\)
=> \(\%Al=\dfrac{27.\dfrac{347}{890}}{40,1}.100\%=26,252\%\)